题目内容
18.屠呦呦带领科研团队研发的新型抗疟疾药---青蒿素,在全球抗击疟疾进程中,拯救了上百万人的生命,因此获得2015年诺贝尔生理或医学奖.青蒿素化学式为C15H22O5,下列说法正确的是( )| A. | 青蒿素中含有42个原子 | B. | 青蒿素是由三种元素组成的化合物 | ||
| C. | 青蒿素中氢元素的质量分数最大 | D. | 青蒿素中C、H元素的质量比为15:22 |
分析 A.根据青蒿素的微观构成,进行分析判断.
B.根据青蒿素化学式的含义进行分析判断.
C.根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
D.根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
解答 解:A.青蒿素是由青蒿素分子构成的,一个青蒿素分子中含有42个原子,故选项说法错误.
B.青蒿素是由碳、氢、氧三种元素组成的化合物,故选项说法正确.
C.青蒿素中碳、氢、氧三种元素的质量比为(12×15):(1×22):(16×5)=90:11:40,则青蒿素中碳元素质量分数最高,故选项说法错误.
D.青蒿素中C、H、O三种元素的质量比为(12×15):(1×22)=90:11,故选项说法错误.
故选:B.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列化学方程式书写正确的是( )
| A. | 2P+2.5O2$\stackrel{点燃}{→}$P2O5 | B. | 2Mg+O2$\stackrel{点燃}{→}$2MgO | ||
| C. | S+O2$\stackrel{点燃}{→}$SO2↑ | D. | 4Fe+3O2$\stackrel{点燃}{→}$2Fe2O3 |
13.空气是一种宝贵的自然资源.
(1)已知空气中各组分的沸点如下表:
工业上用分离液态空气的方法得到大量的氧气.具体操作是:将空气加压降温至-200℃,空气变成了液态;再升温,N2、氩气气体先逸出,接下来氧气逸出.此过程属于物理(填“物理”或“化学”)变化.
(2)氧气是空气中最活泼的组分,许多物质能在氧气中燃烧,例如木炭、硫磺、铁丝等.铁丝在氧气中燃烧观察到的现象是火星四射,放出热量,生成黑色固体,该反应的基本类型是化合反应,在图1集气瓶底部放少量的水或沙,目的是防止灼热的产物使瓶底炸裂.

(3)用图2所示装置测定空气中氧气的含量,实验前一定要检查装置的气密性.将红磷点燃后,放入集气瓶中,充分反应后等集气瓶冷却,打开止水夹,水立即进入集气瓶中,这是因为红磷和氧气反应,装置内压强变小,进入集气瓶的水的体积大约是集气瓶容积的$\frac{1}{5}$,这是因为空气中氧气的体积分数约为21%.
(1)已知空气中各组分的沸点如下表:
| 组分 | 氮气 | 氧气 | 二氧化碳 | 氩气 | 氖气 | 氦气 |
| 沸点(℃) | -195.8 | -183.0 | -78.4 | -185.7 | -245.9 | -268.9 |
(2)氧气是空气中最活泼的组分,许多物质能在氧气中燃烧,例如木炭、硫磺、铁丝等.铁丝在氧气中燃烧观察到的现象是火星四射,放出热量,生成黑色固体,该反应的基本类型是化合反应,在图1集气瓶底部放少量的水或沙,目的是防止灼热的产物使瓶底炸裂.

(3)用图2所示装置测定空气中氧气的含量,实验前一定要检查装置的气密性.将红磷点燃后,放入集气瓶中,充分反应后等集气瓶冷却,打开止水夹,水立即进入集气瓶中,这是因为红磷和氧气反应,装置内压强变小,进入集气瓶的水的体积大约是集气瓶容积的$\frac{1}{5}$,这是因为空气中氧气的体积分数约为21%.


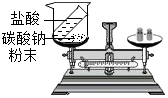 (1)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,发生反应的实验现象为铁钉上附着红色物质,溶液由蓝色逐渐变为浅绿色,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m2,则(填“=”“>”“<”)m1=m2.
(1)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,发生反应的实验现象为铁钉上附着红色物质,溶液由蓝色逐渐变为浅绿色,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m2,则(填“=”“>”“<”)m1=m2.