题目内容
将500g某稀盐酸均分5次加在盛100g石灰石的烧杯中(烧杯质量为50g),每次充分反应后,称得烧杯与残留物的总质量如下表.
试求:
(1)第三次加入稀盐酸并充分反应后,烧杯与残留物的总质量为 g.
(2)该石灰石中含碳酸钙的质量分数;
(3)稀盐酸的溶质质量分数.
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 烧杯与残留物总质量/g | 241.2 | 332.4 | 未测 | 514.8 | 614.8 |
(1)第三次加入稀盐酸并充分反应后,烧杯与残留物的总质量为
(2)该石灰石中含碳酸钙的质量分数;
(3)稀盐酸的溶质质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据质量守恒定律,由反应前后烧杯及所盛物质总质量的差,计算第一次生成二氧化碳的质量;根据质量守恒定律,由反应前后烧杯及所盛物质总质量的差,计算产生二氧化碳的总质量,求出第三次加入稀盐酸并充分反应后,生成二氧化碳的质量即可;
(2)根据二氧化碳的总质量求出该石灰石中含碳酸钙的质量进而求出该石灰石中含碳酸钙的质量分数即可;
(3)根据实验数据分析可知第四次盐酸与碳酸钙恰好反应,求出稀盐酸的溶质质量分数即可.
(2)根据二氧化碳的总质量求出该石灰石中含碳酸钙的质量进而求出该石灰石中含碳酸钙的质量分数即可;
(3)根据实验数据分析可知第四次盐酸与碳酸钙恰好反应,求出稀盐酸的溶质质量分数即可.
解答:解:(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是:100g+100g+50g-241.2g=8.8g;实验中产生二氧化碳的总质量是:400g+100g+50g-514.8g=35.2g,所以第三次加入稀盐酸并充分反应后,生成二氧化碳的质量为8.8g,烧杯与残留物的总质量为332.4g+100g-8.8g=423.6g;故填:423.6;
(2)设该石灰石样品中碳酸钙的质量为x,400g稀盐酸中氯化氢的质量为y.
CaCO3 +2HCl=CaCl2 +H2O+CO2↑
100 73 44
x y 35.2g
=
x=80g
=
y=58.4g
该石灰石中含碳酸钙的质量分数=
×100%=80%
(3)稀盐酸的溶质质量分=
×100%=14.6%
答:(2)该石灰石中含碳酸钙的质量分数为80%;
(3)稀盐酸的溶质质量分数为14.6%.
(2)设该石灰石样品中碳酸钙的质量为x,400g稀盐酸中氯化氢的质量为y.
CaCO3 +2HCl=CaCl2 +H2O+CO2↑
100 73 44
x y 35.2g
| 100 |
| x |
| 44 |
| 35.2g |
x=80g
| 73 |
| y |
| 44 |
| 35.2g |
y=58.4g
该石灰石中含碳酸钙的质量分数=
| 80g |
| 100g |
(3)稀盐酸的溶质质量分=
| 58.4g |
| 400g |
答:(2)该石灰石中含碳酸钙的质量分数为80%;
(3)稀盐酸的溶质质量分数为14.6%.
点评:解答此题的依据是根据方程式找准已知量,未知量关系,列比例式求解即可.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
以下化学名词中包含化学变化的是( )
| A、分馏 | B、催化 | C、吸附 | D、挥发 |
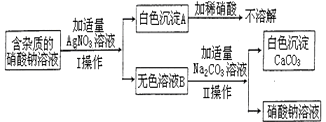 为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如图实验:请回答下列问题:
为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如图实验:请回答下列问题:

