题目内容
1.为了测定某赤铁矿石中氧化铁(Fe2O3)的质量分数,取矿石样品10g,加入146g稀盐酸恰好完全反应,经过滤、干燥后,得到滤渣2g(杂质既不溶于水,也不与盐酸反应).请计算:(1)该赤铁矿石含氧化铁的质量分数.
(2)稀盐酸的溶质质量分数.
分析 题目给出了10g矿石样品中杂质的质量,因此氧化铁的质量可求,根据氧化铁的质量和对应的化学方程式可以求算HCl的质量,进而求算其质量分数.
解答 解:(1)赤铁矿石中氧化铁的质量分数为$\frac{10g-2g}{10g}$×100%=80%.
(2)设盐酸中溶质的质量为x.
Fe2O3+6HCl═2FeCl3+3H2O
160 219
(10g-2g) x
$\frac{160}{219}=\frac{10g-2g}{x}$
解得:x=10.95g
稀盐酸中溶质质量分数为$\frac{10.95g}{146g}$×100%=7.5%.
答:(1)赤铁矿中含氧化铁的质量分数为80%;
(2)盐酸中溶质质量分数为7.5%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
相关题目
12.下表是固体甲和乙在不同温度时的溶解度,下列说法中正确的是( )
| 温度/℃ | 0 | 20 | 40 | 100 |
| 甲溶解度/克 | 0.173 | 0.165 | 0.121 | 0.076 |
| 乙溶解度/克 | 13.3 | 31.6 | 63.9 | 246 |
| A. | 20℃时物质的溶解能力大小关系:甲大于乙 | |
| B. | 20℃时100克乙物质加入100克水中,所得溶液的质量是200克 | |
| C. | 100℃时乙物质的饱和溶液冷却到室温会析出晶体后,溶液仍为饱和溶液 | |
| D. | 20℃时甲物质的饱和溶液升高温度会变为不饱和溶液 |
9.实验小组用如图的装置进行实验.
请你归纳实验目的:加热氯酸钾和二氧化锰的混合物制取氧气并测量收集氧气的体积.
| 实 验 步 骤 | 简 答 |
(1)称取3g氯酸钾与少量二氧化锰混合后放入装置①的试管中,点燃酒精灯. | 装入药品前要检查装置的气密性 ; 分别用中文名称和化学符号写出a试管中发生反应的表达式:氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑. |
(2)加热试管一段时间后,再用橡皮管连接a、b;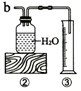 当装置②中水面不再下降,断开a、b,移去酒精灯. | 为什么“加热试管一段时间后,再用橡皮管连接a、b”?原因是:一开始排出的是试管中的空气; ③中使用量筒的作用是通过测量水的体积测量收集的氧气体积. |
16.某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10g水,析出了2g晶体,再恒温蒸发掉10g水,又析出了3g晶体,则下列说法正确的是( )
| A. | 原溶液中t℃时一定是饱和溶液 | |
| B. | t℃时该溶质溶解度为20克 | |
| C. | t℃时该溶质溶解度为30克 | |
| D. | 最后剩余溶液的溶质质量分数比原溶液的溶质质量分数小 |
13.有一包白色固体,可能含有CuCl2、CaCO3、NaOH、Ba(OH)2、BaCl2、Na2SO4中的几种.为确定其组成,取适量试样进行下列实验.请根据实验现象判断:
①取试样溶于水,搅拌、过滤,得到无色澄清溶液A和白色沉淀B;
②取上述无色澄清溶液A,通入适量的CO2,生成白色沉淀C;
③取上述白色沉淀B,加入过量的稀硝酸,沉淀全部消失.
综合上述实验现象,下列判断正确的是( )
①取试样溶于水,搅拌、过滤,得到无色澄清溶液A和白色沉淀B;
②取上述无色澄清溶液A,通入适量的CO2,生成白色沉淀C;
③取上述白色沉淀B,加入过量的稀硝酸,沉淀全部消失.
综合上述实验现象,下列判断正确的是( )
| A. | 由①得原白色固体中一定不含CuCl2,一定含量有CaCO3 | |
| B. | 由②③得原白色固体中一定含有Ba(OH)2,一定不含量有Na2SO4 | |
| C. | 由实验现象判断,白色固体中至少有3种固体 | |
| D. | 由实验现象判断,白色固体的组成可有5种情况 |
10.下列物质的名称、化学式、分类均正确的是( )
| A. | 硫酸钠 NaSO4 盐 | B. | 氧化钙CaO氧化物 | ||
| C. | 烧碱 KOH碱 | D. | 碳酸钠Na2CO3 酸 |
11.实验室许多药品需要密封保存.下列药品需密封保存的原因,解释错误的是( )
| A. | 浓盐酸--防止挥发 | B. | NaOH固体--防止其潮解和变质 | ||
| C. | 浓硫酸--防止吸水 | D. | 生石灰--防止与氧气反应 |
 学习化学时可用如图表示某些从属关系,下列选项正确的是( )
学习化学时可用如图表示某些从属关系,下列选项正确的是( )