题目内容
13.下列有关实验现象的叙述,正确的是( )| A. | 木炭在氧气中燃烧,生成刺激性气味的气体 | |
| B. | 加热硫酸铜晶体,固体会由蓝色变白色 | |
| C. | 红磷在空气中燃烧产生大量白雾 | |
| D. | 铁丝在空气中燃烧,火星四射,生成黑色固体 |
分析 A、根据木炭在氧气中燃烧的现象进行分析判断.
B、根据加热硫酸铜晶体的现象进行分析判断.
C、根据红磷在空气中燃烧的现象进行分析判断.
D、根据铁丝在空气中不能燃烧进行分析判断.
解答 解:A、木炭在氧气中燃烧,生成无色无味的气体,故选项说法错误.
B、加热硫酸铜晶体,固体会由蓝色变白色,故选项说法正确.
C、红磷在空气中燃烧产生大量白烟,故选项说法错误.
D、铁丝在空气中不能燃烧,故选项说法错误.
故选:B.
点评 本题难度不大,掌握常见物质燃烧的现象即可正确解答,在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别.

练习册系列答案
相关题目
5.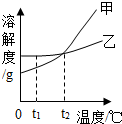 分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
(1)氯化钠的溶解度曲线是乙(填“甲”或“乙”).
(2)20℃时,将40gNH4Cl加入100g的水中,充分搅拌后得到的是饱和溶液(填“饱和”或“不饱和”),将上述溶液升温到30℃,该溶液的溶质质量分数为$\frac{40g}{40g+100g}$×100%(只列计算式,不需计算结果).
(3)如图,t1℃时,将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体最多的是乙(填“甲”或“乙”).
(4)计算配制50g质量分数为3%的NaCl溶液所需要质量分数为6%的NaCl溶液的体积,需要用到的数据是C.
A.3%的NaCl溶液的密度 B.水的密度 C.6%的NaCl溶液的密度.
 分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| NaCl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
| NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(2)20℃时,将40gNH4Cl加入100g的水中,充分搅拌后得到的是饱和溶液(填“饱和”或“不饱和”),将上述溶液升温到30℃,该溶液的溶质质量分数为$\frac{40g}{40g+100g}$×100%(只列计算式,不需计算结果).
(3)如图,t1℃时,将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体最多的是乙(填“甲”或“乙”).
(4)计算配制50g质量分数为3%的NaCl溶液所需要质量分数为6%的NaCl溶液的体积,需要用到的数据是C.
A.3%的NaCl溶液的密度 B.水的密度 C.6%的NaCl溶液的密度.
2.“比较归纳法”是学习化学的一种重要方法.(“-”表示相连的物质之间在溶液中发生化学反应,“→”表示由某种物质可通过一步反应直接转化为另一种物质.)
(1)请以表中序号Ⅰ为示例,填写序号Ⅱ、Ⅲ中的空格:
(2)氯化钠与下列物质的相互反应的关系,正确的是D(选填标号).
A、KNO3-NaCl B、Mg(OH)2-NaCl
C、H2SO4-NaCl D、AgNO3-NaCl.
(1)请以表中序号Ⅰ为示例,填写序号Ⅱ、Ⅲ中的空格:
| 项目 序号 | 举例 | 物质类别间的相互反应 | 物质类别间的相互转化 |
| Ⅰ | Na2CO3+CaCl2=2NaCl+CaCO3↓ | 【盐1】-【盐2】 | 【盐】→【新盐】 |
| Ⅱ | 写出一个氢氧化钠转化生成另一种碱的化学方程式2NaOH+MgCl2=Mg(OH)2↓+2NaCl | 【碱】-【盐】 | 【碱→【新碱】 |
| Ⅲ | 对应写出一个符合要求的相关反应化学方程式BaCl2+H2SO4=BaSO4↓+2HCl | 【酸】-【盐】 | 【酸】→【新酸】 |
A、KNO3-NaCl B、Mg(OH)2-NaCl
C、H2SO4-NaCl D、AgNO3-NaCl.

 如图是家用电熨斗的实物图.请回答下列问题:
如图是家用电熨斗的实物图.请回答下列问题:
 煤、石油和天然气是常见的三种化石燃料,它们属于不可再生能源.随着科学技术的发展以及生产和生活需求的增加,人们正在利用和开发其他新能源.
煤、石油和天然气是常见的三种化石燃料,它们属于不可再生能源.随着科学技术的发展以及生产和生活需求的增加,人们正在利用和开发其他新能源.