题目内容
19.有初中阶段常见的A、B、C、D、E、F、G等七种物质.A为白色固体,加热后放出无色气体B并产生白色固体H;C为黑色固体,它在B中燃烧发出白光,生成气体E;E能使澄清的石灰水浑浊;固体D暴露在空气中会发生自燃,生成另一种白色固体G;气体F可由一种淡黄色固体在B中燃烧产生,它能污染空气.试推断上述七种物质,写出其中某些物质的化学式:AKClO3、CC、FSO2、GP2O5.
分析 根据A、B、C、D、E、F、G等是初中阶段常见的七种物质,E能使澄清的石灰水变浑浊,所以E是二氧化碳,C为黑色固体,在B中燃烧发出白光,生成二氧化碳,所以C是木炭,固体D暴露在空气中会发生自燃,生成另一种白色固体G,所以D是白磷,G就是五氧化二磷,一种淡黄色固体在氧气中燃烧产生一种能污染空气的气体F,所以F是二氧化硫,A为白色固体,加热后放出氧气并产生白色固体H,结合实验室制取氧气的方法和药品可知,所以A是氯酸钾,H是氯化钾,然后将推出的各种物质代入转化关系中验证即可.
解答 解:A、B、C、D、E、F、G等是初中阶段常见的七种物质,E能使澄清的石灰水变浑浊,所以E是二氧化碳,C为黑色固体,在B中燃烧发出白光,生成二氧化碳,所以C是木炭,固体D暴露在空气中会发生自燃,生成另一种白色固体G,所以D是白磷,G就是五氧化二磷,一种淡黄色固体在氧气中燃烧产生一种能污染空气的气体F,所以F是二氧化硫,A为白色固体,加热后放出氧气并产生白色固体H,结合实验室制取氧气的方法和药品可知,所以A是氯酸钾,H是氯化钾,A氯酸钾在加热的条件下生成H氯化钾和B氧气,C木炭在氧气中燃烧生成E二氧化碳,二氧化碳能使澄清石灰水变浑浊,D白磷在空气中会自燃,生成白色固体G五氧化二磷,硫和氧气在点燃的条件下生成F二氧化硫,二氧化硫会污染空气,推出的各种物质均满足题意,推导合理,所以A是氯酸钾,E是二氧化碳,F是二氧化硫,G是五氧化二磷.
故答案为:KClO3,C,SO2,P2O5.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
7.下列哪一项既是光合作用的原料又是呼吸作用的产物?( )
| A. | 氧和二氧化碳 | B. | 氧和有机物 | C. | 水和二氧化碳 | D. | 水和有机物 |
14.2013年全国“两会”的重要议题之一是节约资源和保护环境.下列说法正确的是( )
①禁止使用农药和洗衣粉
②工业废水经处理达标后再排放
③抑制水中所有动植物的生长
④生活污水净化后再排放
⑤鼓励居民购买小汽车,方便出行
⑥研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生
⑦用塑料制品代替木材,生产包装盒、快餐盒等,以减少木材的使用.
①禁止使用农药和洗衣粉
②工业废水经处理达标后再排放
③抑制水中所有动植物的生长
④生活污水净化后再排放
⑤鼓励居民购买小汽车,方便出行
⑥研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生
⑦用塑料制品代替木材,生产包装盒、快餐盒等,以减少木材的使用.
| A. | ②④⑥ | B. | ①③⑦ | C. | ②④⑦ | D. | ④⑤⑥ |
11.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.

(1)用pH试纸测定溶液的pH时,正确的操作是:将pH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,将试纸颜色与比色卡对照读出pH.
(2)简述强调“测得的pH小于7”的理由:盐酸过量,这时溶液呈酸性,溶液的pH小于7.
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是除去氧气和隔绝氧气.实验结果表明酚酞溶液红色消失与空气中的氧气无关.
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈碱性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关.
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法取上述溶液加水稀释后,再滴加无色酚酞
,②观察到的现象溶液呈红色不消失.
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如表).
(1)表中x=7.
(2)某同学在没使用温度计的情况下,通过如图所示装置完成了实验.则该同学根据判断NaOH溶液与稀盐酸发生了中和反应.
(3)关于实验中的细节和意外情况:
①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是U型管中液面左低右高.
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是防止稀盐酸过量.
③在实验过程中意外发现有气泡出现,你认为原因是氢氧化钠溶液中含有碳酸钠.
④发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;你认为:②可能是碳酸钠; ③可能是NaOH与Na2CO3的混合物.
(4)为了进一步研究实验中出现的问题,取了13.3g氢氧化钠固体样品加适量的水配成溶液,
向其中加入200g10%的稀盐酸,使其充分反应,生成二氧化碳2.2g.求:
(1)样品中氢氧化钠的质量;
(2)和氢氧化钠反应的盐酸的质量;
(3)在图2中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸的质量的关系图.
(已知Na2CO3+2HCl═2NaCl+H2O+CO2↑)
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.

(1)用pH试纸测定溶液的pH时,正确的操作是:将pH试纸放在表面皿上,用玻璃棒蘸取少量待测液滴在试纸上,将试纸颜色与比色卡对照读出pH.
(2)简述强调“测得的pH小于7”的理由:盐酸过量,这时溶液呈酸性,溶液的pH小于7.
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是除去氧气和隔绝氧气.实验结果表明酚酞溶液红色消失与空气中的氧气无关.
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:
结论1:说明Na2CO3溶液呈碱性;
结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关.
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法取上述溶液加水稀释后,再滴加无色酚酞
,②观察到的现象溶液呈红色不消失.
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如表).
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
(2)某同学在没使用温度计的情况下,通过如图所示装置完成了实验.则该同学根据判断NaOH溶液与稀盐酸发生了中和反应.
(3)关于实验中的细节和意外情况:
①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是U型管中液面左低右高.
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是防止稀盐酸过量.
③在实验过程中意外发现有气泡出现,你认为原因是氢氧化钠溶液中含有碳酸钠.
④发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;你认为:②可能是碳酸钠; ③可能是NaOH与Na2CO3的混合物.
(4)为了进一步研究实验中出现的问题,取了13.3g氢氧化钠固体样品加适量的水配成溶液,
向其中加入200g10%的稀盐酸,使其充分反应,生成二氧化碳2.2g.求:
(1)样品中氢氧化钠的质量;
(2)和氢氧化钠反应的盐酸的质量;
(3)在图2中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸的质量的关系图.
(已知Na2CO3+2HCl═2NaCl+H2O+CO2↑)
8.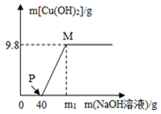 含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,则下列说法不正确的是( )
含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,则下列说法不正确的是( )
 含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,则下列说法不正确的是( )
含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,则下列说法不正确的是( )| A. | m1的数值为80 | |
| B. | P点溶液中的溶质是氯化钠和氯化铜 | |
| C. | M点溶液中的溶质是氯化钠 | |
| D. | 整个反应过程中,溶液中氯离子个数不变 |
9.下列物质分类正确的是( )
| A. | 有机物:甲烷、二氧化碳 | B. | 盐类:烧碱、纯碱 | ||
| C. | 混合物:自来水、冰水共存物 | D. | 氧化物:水、二氧化锰 |