题目内容
14.实验室里加热30g氯酸钾和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为25.2g.请计算:①生成氧气的质量为4.8g;
②原混合物中氯酸钾的物质的量.(根据化学方程式列式计算)
分析 氯酸钾在二氧化锰催化作用下分解生成氯化钾和氧气,反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以计算氯酸钾的质量.
解答 解:(1)反应生成氧气质量为:30g-25.2g=4.8g,
(2)设氯酸钾质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
245 96
x 4.8g
$\frac{245}{x}=\frac{96}{4.8g}$
x=12.25g
原混合物中氯酸钾的物质的量=$\frac{12.25g}{245g/mol}$=0.05mol
答案:
(1)4.8
(2)0.05 mol
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
相关题目
4.实验室现有药品氯酸钾、稀盐酸、二氧化锰、大理石.根据所给药品和下列实验装置图,回答有关问题:
(1)写出图中标号仪器的名称:a长颈漏斗.
(2)用AC装置的组合可以制取并收集氧气,其反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.若用充满水的多功能装置F收集氧气时,氧气需从②(填“①”或“②”)端通入.
(3)实验室可用BD装置的组合制取并收集二氧化碳,发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(4)用上述制取二氧化碳试验后的液体残留物进行蒸发的操作训练,蒸发过程中要不停地搅拌,直到出现较多量固体时(写现象)停止加热.
| 发生装置 | 收集装置 | 多功能瓶 |
 |  |  |
(2)用AC装置的组合可以制取并收集氧气,其反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.若用充满水的多功能装置F收集氧气时,氧气需从②(填“①”或“②”)端通入.
(3)实验室可用BD装置的组合制取并收集二氧化碳,发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(4)用上述制取二氧化碳试验后的液体残留物进行蒸发的操作训练,蒸发过程中要不停地搅拌,直到出现较多量固体时(写现象)停止加热.
2.不能用金属和一种稀酸反应制取的化合物是( )
| A. | AlCl3 | B. | Fe2(SO4)3 | C. | MgCl2 | D. | ZnSO4 |
9.如图为汽车尾气净化装置中发生反应的微观示意图,有关叙述错误的是( )


| A. | 图中单质的化学式为N2 | B. | 反应前后分子、原子种类均不变 | ||
| C. | 反应后分子总数减少 | D. | 原子是化学变化中的最小微粒 |
19.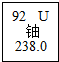 据光明日报2015年10月10日报道,我国科学家在自然界发现金属铀,属全球首次,如图是铀元素的相关信息,其中正确的是( )
据光明日报2015年10月10日报道,我国科学家在自然界发现金属铀,属全球首次,如图是铀元素的相关信息,其中正确的是( )
 据光明日报2015年10月10日报道,我国科学家在自然界发现金属铀,属全球首次,如图是铀元素的相关信息,其中正确的是( )
据光明日报2015年10月10日报道,我国科学家在自然界发现金属铀,属全球首次,如图是铀元素的相关信息,其中正确的是( )| A. | 铀原子的中子数是92 | B. | 铀原子的质量为238.0g | ||
| C. | 铀原子的核外电子数是146 | D. | 铀原子的核电荷数(质子数)是92 |
3.水变成水蒸气的过程中( )
| A. | 水分子的大小发生变化 | B. | 水分子中的原子构成发生变化 | ||
| C. | 水分子的质量发生变化 | D. | 水分子之间的间隙发生变化 |
4. 乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割成焊接金属,乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割成焊接金属,乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.
【查阅资料】电石主要成分为碳化钙(CaC2),它没有可燃性.
【提出问题】白色固体时什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:CaCO3;猜想三:Ca(OH)2;他的依据是质量守恒定律.
【进行实验】
【交流反思】通过上述实验可知,电石在保护和运输时的注意事项防止与水接触.
 乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割成焊接金属,乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割成焊接金属,乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体.【查阅资料】电石主要成分为碳化钙(CaC2),它没有可燃性.
【提出问题】白色固体时什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:CaCO3;猜想三:Ca(OH)2;他的依据是质量守恒定律.
【进行实验】
| 实验步骤 | 实验现象及解释 | 结论 |
| (1)取少量白色固体于试管中,滴加稀盐酸 | 没有气泡 | 猜想二不成立 |
| (2)取少量白色固体加入水中,取上层清液,通入CO2 | 变浑浊,反应的方程式为 Ca(OH)2+CO2=CaCO3↓+H2O | 猜想三成立 |
