题目内容
13.图1为“钙尔奇”的部份说明书,某同学想研究其中碳酸的含量,于是他取5片该药片放入足量的稀盐酸中,产生的二氧化碳与盐酸的用量关系如图2.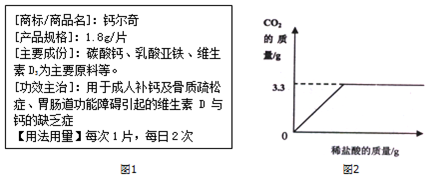
(1)完全反应产生的二氧化碳的体积为1.65L (在通常状况下CO2的密度为约为2.0g/L)
(2)该药片中碳酸钙的质量分数.(写出计算过程,保留0.1%)
分析 根据图中给出的二氧化碳的质量结合二氧化碳的密度求算对应的体积,结合二氧化碳的质量和对应的化学方程式求算碳酸钙的质量,进而求算药品中碳酸钙的质量分数.
解答 解:
(1)二氧化碳的体积等于$\frac{3.3g}{2.0g/L}$=1.65L.
(2)设生成3.3g二氧化碳需要的碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3g
$\frac{100}{44}$=$\frac{x}{3.3g}$
x=7.5g
则样品中碳酸钙的质量分数为$\frac{7.5g}{1.8g×5}$×100%≈83.3%
答:(1)完全反应产生的二氧化碳的体积为 1.65L;
(2)该药片中碳酸钙的质量分数为83.3%.
点评 根据质量求气体的体积应该是质量除以密度,这个很多学生会错误计算为质量乘以密度.

练习册系列答案
相关题目
4.欲除去密闭容器中空气里的氧气,从而得到较纯净地氮气,应在容器中充分燃烧的物质是( )
| A. | 硫粉 | B. | 氢气 | C. | 木炭 | D. | 白磷 |
1.如图是元素周期表中的一格,下列有关磷元素的说法正确的是( )
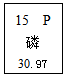

| A. | 相对原子质量是15 | B. | 原子序数是15 | ||
| C. | 该元素属于金属元素 | D. | 一个磷原子的质量是30.97g |
8.化学反应中,反应前后可能发生变化的是( )
| A. | 原子的种类 | B. | 分子的数目 | C. | 元素的种类 | D. | 原子的数目 |
