题目内容
某学习小组的同学为了测定工厂废液中氢氧化钠的含量,他们取了该废液100g,恰好能与50g质量分数为7.3%的稀盐酸完全中和.试计算:废液中氢氧化钠的溶质质量分数(假定其他杂质不参加反应).(提示:NaOH+HCl=NaCl+H2O)
消耗的50g盐酸中含氯化氢的质量为:50g×7.3%=3.65g,
设废液中含NaOH的质量为x,
HCl+NaOH═NaCl+H2O
36.5 40
3.65g x
=
解得:x=4g
所以废液中所含氢氧化钠的质量分数:
×100%=4%
答:废液中所含氢氧化钠的质量分数是4%.
设废液中含NaOH的质量为x,
HCl+NaOH═NaCl+H2O
36.5 40
3.65g x
| 36.5 |
| 3.65g |
| 40 |
| x |
解得:x=4g
所以废液中所含氢氧化钠的质量分数:
| 4g |
| 100g |
答:废液中所含氢氧化钠的质量分数是4%.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
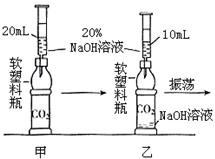 (2010?长沙)将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了观察到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题.
(2010?长沙)将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了观察到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题. 将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了看到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题.
将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了看到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题. 将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了看到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题.
将CO2通入NaOH溶液中无明显现象.某学习小组的同学为了看到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验.请根据实验过程及内容,思考并回答相关问题.