题目内容
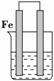
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应: _______________________________________________;
银片上发生的电极反应: ________________________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电量为1.60×10-19C)
答案 (1)Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)①4.48 L ②3.85×104 C
解析 (1)根据金属活动性分析得出锌片为负极,银片为正极,相应电极反应式为Zn-2e-===Zn2+;2H+ +2e-===H2↑。
(2)①锌片与银片总质量减轻,是因锌片与酸反应:
Zn+2H+===Zn2++H2↑~转移2e-
65 g 22.4 L 2×6.02×1023
60 g-47 g V(H2) Q/1.60×10-19
得V(H2)=4.48 L;Q=3.85×104 C

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
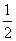 c(Na+)=c(HCO
c(Na+)=c(HCO )+c(CO
)+c(CO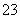 )+c(H2CO3)
)+c(H2CO3)