题目内容
某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中称取生铁样品5.8g放入烧杯中(烧杯的质量为30g),然后再加入50g稀硫酸,使之充分反应后,称量,烧杯及烧杯中物质的总质量为85.6g(已知该反应中稀硫酸足量,杂质不参加反应).请计算:
(1)产生氢气的质量为多少?
(2)该生铁样品中铁的质量分数?(结果保留一位小数)
(1)产生氢气的质量为多少?
(2)该生铁样品中铁的质量分数?(结果保留一位小数)
分析:因为铁和稀硫酸反应会产生氢气,根据质量守恒定律可知,反应后减少的总质量即为生成氢气的质量.然后根据铁和稀硫酸反应的化学方程式,利用氢气的质量可求出参加反应的铁的质量,进而求出生铁中铁的质量分数.
解答:解:反应生成氢气的质量为:5.8g+30g+50g-85.6g=0.2g
设参加反应的铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.2g
=
x=5.6g
所以生铁中铁的质量分数为:
×100%=96.6%
答:(1)产生氢气的质量为0.2g.
(2)该生铁样品中铁的质量分数为96.6%.
设参加反应的铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.2g
| 56 |
| 2 |
| x |
| 0.2g |
所以生铁中铁的质量分数为:
| 5.6g |
| 5.8g |
答:(1)产生氢气的质量为0.2g.
(2)该生铁样品中铁的质量分数为96.6%.
点评:此题是利用化学方程式的计算,其中利用反应前后总质量的差值来求产生气体的质量是此类题常用的方法.此题在求生铁中铁的质量分数上增加了计算的难度.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
(2009?天河区一模)某研究性学习小组的学生在学习完分子的特征后,做了如下两个实验,请按要求填空:
| 实验步骤 | 实验现象 | 实验结论或解释 |
| 实验一:在两个相同的茶杯内分别注入同体积的凉开水,一只杯子里加一小匙蜂蜜(主要成分是果糖),另一只杯子里加一小匙白醋(主要成分是醋酸),立即尝两只杯子里的水. | 放蜂蜜的杯子里的水基本不甜,放白醋的杯子里的水很酸. | ______分子的运动的速度比______分子的运动速度快,这说明相对分子质量越小的物质其分子的运动速度就______.(填“快”或“慢”)(提示:醋酸分子的相对分子质量比果糖分子的相对分子质量小.) |
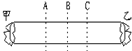
实验二:如图所示的玻璃管两端甲、乙两处分别放着蘸有浓氨水和浓盐酸的棉花. | 在______处出现较多白烟(填A或B或C). | 浓氨水挥发出来的氨分子(NH3)和浓盐酸挥发出来的氯化氢分子(HCl )接触时会产生大量的白烟. |
25.(2009?天河区一模)某研究性学习小组的学生在学习完分子的特征后,做了如下两个实验,请按要求填空:
| 实验步骤 | 实验现象 | 实验结论或解释 |
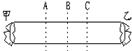
| 实验一:在两个相同的茶杯内分别注入同体积的凉开水,一只杯子里加一小匙蜂蜜(主要成分是果糖),另一只杯子里加一小匙白醋(主要成分是醋酸),立即尝两只杯子里的水. | 放蜂蜜的杯子里的水基本不甜,放白醋的杯子里的水很酸. | ______分子的运动的速度比______分子的运动速度快,这说明相对分子质量越小的物质其分子的运动速度就______.(填“快”或“慢”)(提示:醋酸分子的相对分子质量比果糖分子的相对分子质量小.) |
实验二:如图所示的玻璃管两端甲、乙两处分别放着蘸有浓氨水和浓盐酸的棉花. | 在______处出现较多白烟(填A或B或C). | 浓氨水挥发出来的氨分子(NH3)和浓盐酸挥发出来的氯化氢分子(HCl )接触时会产生大量的白烟. |