题目内容
8.某学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物 ②沼气和石油都是可再生资源 ③冰和干冰既是纯净物又是氧化物 ④不锈钢和目前流通的硬币都是合金 ⑤盐酸和食醋既是化合物又是酸 ⑥纯碱和熟石灰都是碱.上述说法正确的是( )| A. | ①②③ | B. | ①②⑥ | C. | ①③④ | D. | ③⑤⑥ |
分析 物质分为混合物和纯净物,纯净物又分为单质和化合物,化合物分为氧化物、酸、碱、盐;①粗盐中有杂质和食盐,酸雨中有酸和水,它们都是混合物;②沼气和石油都是可再生资源是错误的,煤、石油、天然气都属于不可再生的能源;③冰是水的固体,干冰是二氧化碳的固体,它们既是纯净物又是氧化物正确;④不锈钢和目前流通的硬币都是合金正确,它们都是混合物;⑤盐酸和食醋既是化合物又是酸是错误的,盐酸属于混合物;⑥纯碱和熟石灰都是碱是错误的,纯碱属于盐.
解答 解:A、②沼气和石油都是可再生资源是错误的,煤、石油、天然气都属于不可再生的能源;故选项错误;
B、②沼气和石油都是可再生资源是错误的,煤、石油、天然气都属于不可再生的能源;⑥纯碱和熟石灰都是碱是错误的,纯碱属于盐,故选项错误;
C、①粗盐中有杂质和食盐,酸雨中有酸和水,它们都是混合物;③冰是水的固体,干冰是二氧化碳的固体,它们既是纯净物又是氧化物正确;④不锈钢和目前流通的硬币都是合金正确,它们都是混合物;故选项正确;
D、⑤盐酸和食醋既是化合物又是酸是错误的,盐酸属于混合物;⑥纯碱和熟石灰都是碱是错误的,纯碱属于盐,故选项错误;
故选C
点评 本考点考查了物质的分类、合金和能源等,要加强记忆有关的知识点,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
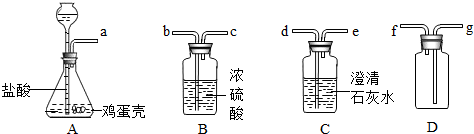
19.科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环(如图1所示).某化学小组的同学对此非常感兴趣,在老师的指导下,设计如图2装置探究上述设想的反应原理是否可行.

(1)能证明装置A“释放CO2”的现象是C中的石灰水变浑浊;
(2)上述反应结束后,小组同学对D中固体的成分进行探究,以证明是否“捕捉”到CO2.
【猜想与假设】
D中的固体可能为:Ⅰ.只有氧化钙;Ⅱ.氧化钙与碳酸钙;Ⅲ.只有碳酸钙
【进行实验】
①甲同学从D中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物.甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立.乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是氧化钙与水反应生成的氢氧化钙微溶,也可能出现不溶物.
②乙同学从D中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生.乙同学据此认为试管中的固体只有氧化钙,即猜想I成立.丙同学认为乙的实验不足以证明猜想I成立,理由是由于滴加盐酸的量太少,盐酸先于氢氧化钙反应,即使有碳酸钙,也不会出现气泡.
③丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和
稀盐酸证明了猜想Ⅱ成立,请完成他的实验报告.
(3)通过以上探究,小组同学认为科学家的设想在反应原理上是可行的.该设想的优点有ABC(填字母序号).
A.原料易得 B.充分利用太阳能 C.释放出的CO2可作为资源加以利用.

(1)能证明装置A“释放CO2”的现象是C中的石灰水变浑浊;
(2)上述反应结束后,小组同学对D中固体的成分进行探究,以证明是否“捕捉”到CO2.
【猜想与假设】
D中的固体可能为:Ⅰ.只有氧化钙;Ⅱ.氧化钙与碳酸钙;Ⅲ.只有碳酸钙
【进行实验】
①甲同学从D中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物.甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立.乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是氧化钙与水反应生成的氢氧化钙微溶,也可能出现不溶物.
②乙同学从D中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生.乙同学据此认为试管中的固体只有氧化钙,即猜想I成立.丙同学认为乙的实验不足以证明猜想I成立,理由是由于滴加盐酸的量太少,盐酸先于氢氧化钙反应,即使有碳酸钙,也不会出现气泡.
③丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和
稀盐酸证明了猜想Ⅱ成立,请完成他的实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量D中固体,加水充分溶解,过滤 ①取滤液,滴加几滴无色酚酞试液 ②向滤出的固体中滴加足量的稀盐酸 | ①溶液变为红色 ②固体表面有气泡冒出 | 猜想Ⅱ成立 |
A.原料易得 B.充分利用太阳能 C.释放出的CO2可作为资源加以利用.
16.以下应用守恒思想解决相关问题,推论正确的是( )
| A. | 2g氢气与18g氧气反应,根据质量守恒推出生成的水的质量为20g | |
| B. | 丙烷燃烧生成二氧化碳和水,根据元素守恒推出丙烷由碳、氢、氧元素组成 | |
| C. | 100mL36%的浓盐酸用300 mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为9% | |
| D. | 相同分子数的CO和O2混合,在一定条件下充分反应,根据原子守恒推出反应后气体中C、O原子数比为1:3 |
3.下列有关物质的名称、俗名、化学式中,三者皆指同一物质的是( )
| A. | 氢氧化钙、熟石灰、Ca(OH)2 | B. | 氯化氢、盐酸、HCl | ||
| C. | 碳酸钙、熟石灰、CaCO3 | D. | 氧化钙、消石灰、CaO |
20.当前,食品药品安全问题备受人们关注.下列有关做法正确的是( )
| A. | 为降低成本,用工业明胶制药胶囊 | |
| B. | 在乳制品中添加“皮革蛋白粉”,以提高蛋白质含量 | |
| C. | 目前我国多省份大力推广“加铁酱油”,以预防缺铁性贫血 | |
| D. | 将地沟油和泔水油回收用来炒菜,以达到变废为宝、节约资源的目的 |
17.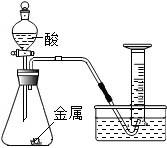 某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
【提出问题】金属与盐酸反应速率受哪些因素影响?
【猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关;c…
【设计探究】实验所用的金属均已用砂纸打磨.
实验A:为探究猜想a,小明同学分别在两支试管中放入相同质量的锌片和铁片,分别加入相同体积和浓度的稀盐酸,观察到盐酸与锌片反应比与铁片反应产生的气泡快,请写出其中的一个化学反应方程式Zn+2HCl=ZnCl2+H2↑;Fe+2HCl=FeCl2+H2↑.
从实验现象可以判断:金属活动性Zn> Fe(填“>”“<”或“=”).
【得出结论】金属与盐酸反应的速率与金属本身性质有关.金属活动性与反应的速率的关系是金属活动性越强,反应的程度越剧烈.
实验B:为探究猜想b,小明设计如图所示的装置进行实验,所用药品及实验数据如表:
得出结论:金属与盐酸发生反应的速率与盐酸的浓度有关,即盐酸浓度越大,反应程度越剧烈.
【反思评价】根据实验Ⅰ、Ⅱ数据分析,解释锌与盐酸反应速率快慢的变化原因锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.
【新猜想】通过以上探究,你认为金属与盐酸反应的速率度还可能受哪些因素影响.金属表面积.(写一条即可)
【继续探究】请对你提出的新猜想,设计实验证明,并总结出合理的结论.分别取相同质量的大颗锌粒和小颗锌粒,与相同浓度、相同质量的稀盐酸在相同温度下反应(控制其他因素不变),观察到小颗锌粒与酸反应速率快.结论:金属表面积越大,金属与酸反应的越快.
 某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:【提出问题】金属与盐酸反应速率受哪些因素影响?
【猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关;c…
【设计探究】实验所用的金属均已用砂纸打磨.
实验A:为探究猜想a,小明同学分别在两支试管中放入相同质量的锌片和铁片,分别加入相同体积和浓度的稀盐酸,观察到盐酸与锌片反应比与铁片反应产生的气泡快,请写出其中的一个化学反应方程式Zn+2HCl=ZnCl2+H2↑;Fe+2HCl=FeCl2+H2↑.
从实验现象可以判断:金属活动性Zn> Fe(填“>”“<”或“=”).
【得出结论】金属与盐酸反应的速率与金属本身性质有关.金属活动性与反应的速率的关系是金属活动性越强,反应的程度越剧烈.
实验B:为探究猜想b,小明设计如图所示的装置进行实验,所用药品及实验数据如表:
| 实验编号 | 选用金属 (均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 0~1min | 1~2min | 2~3min | 3~4min | 4~5min | 前5min共收集气体 | |||
| Ⅰ | 锌片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 47.6 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据实验Ⅰ、Ⅱ数据分析,解释锌与盐酸反应速率快慢的变化原因锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.
【新猜想】通过以上探究,你认为金属与盐酸反应的速率度还可能受哪些因素影响.金属表面积.(写一条即可)
【继续探究】请对你提出的新猜想,设计实验证明,并总结出合理的结论.分别取相同质量的大颗锌粒和小颗锌粒,与相同浓度、相同质量的稀盐酸在相同温度下反应(控制其他因素不变),观察到小颗锌粒与酸反应速率快.结论:金属表面积越大,金属与酸反应的越快.
 已知A、B、C、D、E、F、G、H、M、N均为初中化学中常见的物质,其中A、C、D、M、F为氧化物,组成A与C的元素种类相同;H为可溶性碱;固体X在B中充分燃烧可生成无色气体D;E为常用建筑材料的主要成分.各物质之间的相互关系如图所示(部分反应条件和生成物已省略)
已知A、B、C、D、E、F、G、H、M、N均为初中化学中常见的物质,其中A、C、D、M、F为氧化物,组成A与C的元素种类相同;H为可溶性碱;固体X在B中充分燃烧可生成无色气体D;E为常用建筑材料的主要成分.各物质之间的相互关系如图所示(部分反应条件和生成物已省略)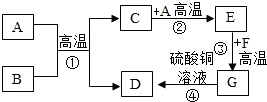 A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题:
A-H都是初中化学中常见的物质.已知A、B都是黑色固体.D、F为红色固体,它们之间的转化关系如图所示,请回答下列问题: