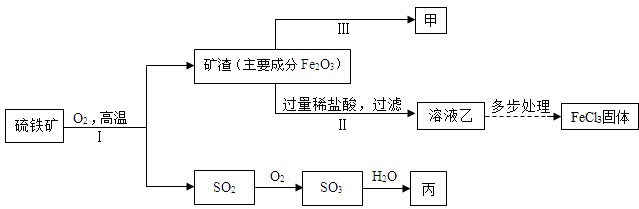
题目内容
1.金属在生产和生活中具有广泛的应用.(1)下列金属制品中,利用金属导热性的是C(填序号).

(2)为防止铁制品锈蚀,通常在铁制品表面喷漆,其防锈原理是使铁制品与氧气和水隔绝.铝的化学性质比铁活泼,但通常铝制品比铁制品更耐腐蚀的原因是铝易与空气中的氧气反应在其表面形成一层致密的氧化膜.
(3)某兴趣小组欲探究Fe、Cu、Ag、R四种金属的活动性顺序(R为未知金属),进行了如下实验:

①如图A所示,将四根金属丝同时插入烧杯中.甲中可观察到的现象是铁丝表面产生气泡,溶液由无色变为浅绿色.乙中发生反应的化学方程式是Fe+CuSO4=FeSO4+Cu.
②一段时间后,将烧杯中铁丝替换为R进行实验,如图B所示.若甲中出现气泡,乙中无明显现象,则烧杯乙中的溶质是FeSO4,可得出Fe、Cu、Ag、R的活动性顺序由强到弱为Fe>R>Cu>Ag.
分析 (1)依据金属制品的用途分析性质;
(2)根据铁生锈的条件、铝的化学性质分析回答;
(3)根据铁与硫酸、硫酸铜的反应分析现象、写出反应的化学方程式;根据金属与酸、盐能否反应可以比较金属的活泼性的大小.
解答 解:(1)A、黄金饰品是利用金属的光泽;B、铜导线是利用金属导电性铁;C、锅炒锅是利用金属导热性.所以C符合题意;
(2)为防止铁制品锈蚀,通常在铁制品表面喷漆,其防锈原理是使铁制品与氧气和水隔绝.铝的化学性质比铁活泼,但通常铝制品比铁制品更耐腐蚀的原因是:铝易与空气中的氧气反应,在其表面形成一层致密的氧化膜.
(3)①由图示可知,在甲中铁能与硫酸反应生成了氢气和硫酸亚铁,可观察到的现象是:铁丝表面产生气泡,溶液由无色变为浅绿色.乙中铁能与硫酸铜反应生成了硫酸亚铁和铜,发生反应的化学方程式是:Fe+CuSO4=FeSO4+Cu.
②一段时间后,将烧杯中铁丝替换为R进行实验,由于甲中出现气泡,说明了R在金属活动性顺序表中,位于氢的前边,由于乙中无明显现象,烧杯乙中的溶质是FeSO4,说明R的活泼性小于铁,可得出Fe、Cu、Ag、R的活动性顺序由强到弱为Fe>R>Cu>Ag.
故答为:(1)C;(2)氧气和水,铝易与空气中的氧气反应,在其表面形成一层致密的氧化膜;
(3)①气泡,Fe+CuSO4=FeSO4+Cu;②FeSO4;Fe>R>Cu>Ag.
点评 在金属活动性顺序中,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,要比较金属的活动性大小,常用金属与盐溶液的反应.要验证三种金属活动性大小关系时,通常采取“三取中”的方法即:取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
12.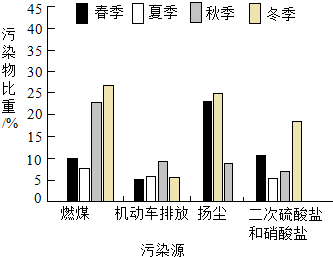 如图为北京市PM2.5污染物来源的季节变化特征,其中季节变化特征最不明显的污染源来自( )
如图为北京市PM2.5污染物来源的季节变化特征,其中季节变化特征最不明显的污染源来自( )
 如图为北京市PM2.5污染物来源的季节变化特征,其中季节变化特征最不明显的污染源来自( )
如图为北京市PM2.5污染物来源的季节变化特征,其中季节变化特征最不明显的污染源来自( )| A. | 燃煤 | B. | 机动车排放 | ||
| C. | 扬尘 | D. | 二次硫酸盐和硝酸盐 |
9.某物质在氧气中燃烧产生明亮的蓝紫色火焰,且有刺激性气味的气体产生,该物质是( )
| A. | 硫 | B. | 木炭 | C. | 红磷 | D. | 镁条 |
16.下列各组物质的鉴别方法不正确的是( )
| 选项 | 物质 | 鉴别方法 |
| A | 氧化铜粉末和铁粉 | 用磁铁吸引 |
| B | 氢氧化钠和硝酸铵 | 加水后测温度变化 |
| C | 氯化铵和硫酸铵 | 加入熟石灰粉末研磨 |
| D | 羊毛纤维和合成纤维 | 点燃后闻气味 |
| A. | A | B. | B | C. | C | D. | D |
6.某化学兴趣小组设计四种实验方案来证明炭粉中是否含有氧化铜.其中可行的是( )
| A. | 将固体高温加热,看是否有红色固体生成 | |
| B. | 在样品中加稀硫酸,充分反应后,观察是否有固体剩余 | |
| C. | 在样品中加水,是否有蓝色沉淀 | |
| D. | 在样品中加硫酸,充分反应后,溶液是否呈蓝色 |
13.在CuCl2和ZnCl2的混合液中加过量的铁粉,充分反应后过滤,留在滤纸上的物质是( )
| A. | Cu | B. | Fe | C. | Cu和Zn | D. | Cu和Fe |