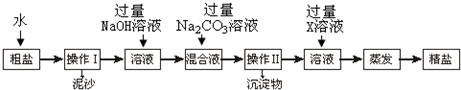
题目内容
11.某化学兴趣小组,为了测定铜锌合金样品中锌的含量,称取样品20克于烧杯中,向其中加入50克稀硫酸至恰好完全反应,反应后烧杯中物质的总质量为69.8克,求:(1)样品中锌的质量分数?
(2)恰好完全反应后所得溶液中溶质的质量分数?
分析 (1)根据质量守恒定律计算生成氢气的质量;
(2)根据生成氢气的质量,依据化学方程式进行计算.
解答 解:(1)生成氢气的质量为:20g+50g-69.8g=0.2g
设参加反应的锌的质量为x,生成硫酸锌质量为y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
$\frac{65}{x}$=$\frac{161}{y}$=$\frac{2}{0.2g}$
x=6.5g
y=16.1g
样品中锌的质量分数为:$\frac{6.5g}{20g}$×100%=32.5%;
恰好完全反应后所得溶液中溶质的质量分数为:$\frac{16.1g}{50g+6.5g-0.2g}$×100%≈28.6%.
故答案为:(1)32.5%;
(2)恰好完全反应后所得溶液中溶质的质量分数为28.6%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

练习册系列答案
相关题目
19.碘酸钙是一种补碘、补钙的添加剂,其化学式为 Ca(IO3)2,碘酸钙中碘元素的化合价是( )
| A. | +5 | B. | +1 | C. | -1 | D. | +7 |
16.下列实验操作不正确的是( )
| A. |  取用液体 | B. |  加热液体 | C. |  稀释浓硫酸 | D. |  蒸发食盐水 |
3.在密闭容器中,某反应在点燃的条件下发生,涉及甲、乙、丙和丁四种物质,它们的微观示意图和反应前后的质量如表所示
(1)甲的化学式为H2S.
(2)表中的四种物质中,含氧元素的化合物是丙、丁(填物质序号).
(3)上述反应的化学方程式为2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+2SO2.
(4)一位同学在计算x,y和z数值的过程中,列出了以下等式,其中正确的是D(填字母序号)
A.x+y+z=86
B.y+z=85
C.(50-x):z=32:64
D.(50-x):(y-1)8:3.
| 物质序号 | 甲 | 乙 | 丙 | 丁 | 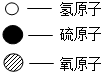 |
| 微观示意图 |  |  |  |  | |
| 反应前质量/g | 34 | 50 | 1 | 0 | |
| 反应后质量/g | 0 | x | y | z |
(2)表中的四种物质中,含氧元素的化合物是丙、丁(填物质序号).
(3)上述反应的化学方程式为2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+2SO2.
(4)一位同学在计算x,y和z数值的过程中,列出了以下等式,其中正确的是D(填字母序号)
A.x+y+z=86
B.y+z=85
C.(50-x):z=32:64
D.(50-x):(y-1)8:3.
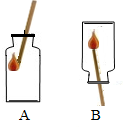 将两装满氧气的集气瓶,按如图所示,用带火星的木条分别用A、B两种方式迅速插入,观察到木条复燃,且在A中燃烧比在B中燃烧更旺.从以上实验现象可知氧气的性质有:
将两装满氧气的集气瓶,按如图所示,用带火星的木条分别用A、B两种方式迅速插入,观察到木条复燃,且在A中燃烧比在B中燃烧更旺.从以上实验现象可知氧气的性质有: