题目内容
2.某地农村井水中含有较多的氯化镁,苦味很重,人蓄都无法饮用.人们往水中倒入一些生石灰,澄清后水中的苦味就消失了.请写出其反应原理的化学方程式:(1)CaO+H2O═Ca(OH)2;
(2)MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.
氯化镁溶液与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
故答案为:(1)CaO+H2O═Ca(OH)2;(2)MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
相关题目
13.“钻石恒久远,一颗永流传”的广告词充分体现钻石具有的性质是( )
| A. | 硬度较小 | B. | 密度较大 | C. | 导电性好 | D. | 化学性质稳定 |
10.下列化学用语与含义不相符的是( )
| A. | Al3+--铝离子 | B. | 3H--3个氢元素 | ||
| C. | Fe3O4--四氧化三铁 | D. | 2N2--2个氮分子 |
17. 如图为某同学制作的用浓硫酸催化甲酸(HCOOH)制取CO还原氧化铜的微型实验装置,下列说法不正确的是( )
如图为某同学制作的用浓硫酸催化甲酸(HCOOH)制取CO还原氧化铜的微型实验装置,下列说法不正确的是( )
 如图为某同学制作的用浓硫酸催化甲酸(HCOOH)制取CO还原氧化铜的微型实验装置,下列说法不正确的是( )
如图为某同学制作的用浓硫酸催化甲酸(HCOOH)制取CO还原氧化铜的微型实验装置,下列说法不正确的是( )| A. | Y型管中发生的反应为:HCOOH$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$H2O+CO↑ | |
| B. | 观察到的现象是氧化铜变成了铜,且澄清石灰水变浑浊 | |
| C. | 此实验装置的主要优点尾气处理有效节能 | |
| D. | 眼药水瓶可改用注射器代替 |
7.某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究.
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
【提出问题】实验方案(3)褪色后溶液中的溶质是什么?
【查阅资料】氯化钙溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙②氯化钙和氯化氢③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙.
探究二:丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴加边振荡.实验后得出产生沉淀质量与碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象滴加碳酸钠溶液,开始先产生气泡,随后才产生沉淀,溶液最终变红色.

【得出结论】乙同学的猜想中,②(填序号)合理.
【反思讨论】学习小组结合图象,分析了丁同学实验过程中烧杯内溶液的变化.下列说法正确的是AB(填序号)
A.溶液质量逐渐增大 B.氯化钠质量逐渐增大,V2后不变
C.氯化钙的质量先增大后减小 D.溶液的pH一直增大.
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
| 方案 | (1) | (2) | (3) |
| 实验操作 | 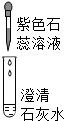 | 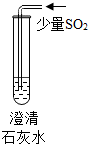 |  |
| 现象 | 溶液变为蓝色 | 澄清石灰水变浑浊 | 红色褪为无色 |
| 结论或解释 | 氢氧化钙溶液能使石蕊等酸碱指示剂变色 | 氢氧化钙溶液能与某些非金属氧化物反应生成盐和水.二氧化硫与澄清石灰水反应的化学方程式是SO2+Ca(OH)2═CaSO3↓+H2O. | 氢氧化钙溶液能与酸发生中和反应 |
【查阅资料】氯化钙溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙②氯化钙和氯化氢③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙.
探究二:丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴加边振荡.实验后得出产生沉淀质量与碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象滴加碳酸钠溶液,开始先产生气泡,随后才产生沉淀,溶液最终变红色.

【得出结论】乙同学的猜想中,②(填序号)合理.
【反思讨论】学习小组结合图象,分析了丁同学实验过程中烧杯内溶液的变化.下列说法正确的是AB(填序号)
A.溶液质量逐渐增大 B.氯化钠质量逐渐增大,V2后不变
C.氯化钙的质量先增大后减小 D.溶液的pH一直增大.
14.化学与人类进步和社会发展的关系非常密切,下列说法不合理的是( )
| A. | 有计划、合理地开采矿物,并利用新技术寻找金属的代用品,以保护金属资源 | |
| B. | 推广使用车用乙醇汽油,可适当节省石油资源,并有效上地减少汽车尾气污染 | |
| C. | 将污水经物理、化学等方法进行分级处理后可达到农灌或绿化用水标准 | |
| D. | 塑料制品的成本低,而且耐用、防水,应大力提倡使用 |
 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答: 我市自来水的处理过程如图所示:
我市自来水的处理过程如图所示: