题目内容
7.化学实验小组同学为了验证“盐酸除去铁块表面锈迹后黄色溶液的成分”,进行了如下探究.【查阅资料】
①Fe+2FeCl3═3FeCl2.
②在酸性条件下,FeCl2可以使高锰酸钾溶液褪色,并生成FeCl3.
③FeCl3溶液可以与KSCN溶液反应,溶液变为血红色.
【猜想与假设】黄色液体中含有FeCl3、FeCl2和HCl.
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 | |
| 甲同学 | 取1支试管,加入少量黄色液体,然后滴加高锰酸钾溶液,再滴加KSCN溶液 | 高锰酸钾溶液褪色,溶液变为血红色 | 黄色溶液中有HCl、FeCl2和FeCl3 |
| 乙同学 | 取2支试管,分别加入少量黄色溶液.再向试管①中滴加KSCN溶液;向试管②中加入铁粉,再滴加高锰酸钾溶液 | 试管①中溶液变为血红色;试管②中产生大量气泡,高锰酸钾溶液褪色 | 黄色溶液中有HCl、FeCl2和FeCl3 |
| 丙同学 | 取3支试管,分别加入少量黄色溶液.再向试管①中滴加KSCN溶液;试管②中加入铁粉;试管③中滴加高锰酸钾溶液 | 试管①中溶液变为血红色;试管②…;试管③中高锰酸钾溶液褪色 | 黄色溶液中有HCl、FeCl2和FeCl3 |
(2)丙同学试管②中的实验现象为产生大量气泡.
(3)三位同学的方案不合理的是甲和乙,原因是甲:依据资料②,FeCl2和高锰酸钾反应时生成了FeCl3,无法证明黄色溶液中有FeCl3
乙:依据资料①,加入Fe粉时,Fe与盐酸或FeCl3反应生成了FeCl2,无法证明黄色溶液中有FeCl2.
【实验反思】
(4)在混合物中,各种成分能(填“能”或“不能”)保持各自的化学性质.
(5)在混合体系中检验多种物质存在时,要考虑物质间的相互影响;物质检验的顺序;所加检验试剂的用量等(答出1条即可).
分析 (1)根据氧化铁与稀盐酸反应生成氯化铁和水,写出反应的化学方程式解答;
(2)根据题中信息和实验结论分析解答;
(3)在酸性条件下,FeCl2可以使高锰酸钾溶液褪色,并生成FeCl3解答;
(4)根据混合物中相互之间不反应解答;
(5)根据在混合体系中检验多种物质存在时,要考虑物质间的相互影响;物质检验的顺序;所加检验试剂的用量等解答.
解答 解:
(1)氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
(2)取3支试管,分别加入少量黄色溶液.再向试管①中滴加KSCN溶液;试管②中加入铁粉;试管③中滴加高锰酸钾溶液,试管①中溶液变为血红色,说明黄色溶液中有FeCl3,试管②种溶液中产生大量气泡,说明黄色溶液中有HCl,试管③中高锰酸钾溶液褪色,说明黄色溶液中有FeCl2;
(3)三位同学的方案不合理的是甲和乙;
甲中取1支试管,加入少量黄色液体,然后滴加高锰酸钾溶液,再滴加KSCN溶液,高锰酸钾溶液褪色,溶液变为血红色,不能说明黄色溶液中有FeCl3
,因为依据资料②,FeCl2和高锰酸钾反应时生成了FeCl3,无法证明黄色溶液中有FeCl3;
乙中依据资料①,加入Fe粉时,Fe与盐酸或FeCl3反应生成了FeCl2,无法证明黄色溶液中有FeCl2
(4)混合物中相互之间不反应,各种成分能保持各自的化学性质.
(5)在混合体系中检验多种物质存在时,要考虑物质间的相互影响;物质检验的顺序;所加检验试剂的用量等.
答案:
(1)Fe2O3+6HCl═2FeCl3+3H2O;
(2)产生大量气泡;
(3)故答案为:甲和乙
甲:依据资料②,FeCl2和高锰酸钾反应时生成了FeCl3,无法证明黄色溶液中有FeCl3
乙:依据资料①,加入Fe粉时,Fe与盐酸或FeCl3反应生成了FeCl2,无法证明黄色溶液中有FeCl2
(4)能;
(5)要考虑物质间的相互影响;物质检验的顺序;所加检验试剂的用量等(合理即得分).
点评 本题考查学生铁以及化合物的性质、亚铁离子和三价铁离子的检验知识,属于综合知识的考查,难度不大.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案请回答下列问题:

【实验过程】
(1)称量与溶解
①调节托盘天平(如图甲):使游码回零,若天平指针偏向左边,可将左边螺母向右(填“左”或“右”)旋动,使指针摆动达到平衡.
②用托盘天平称取粗盐的质量为2g(只用到游码,平衡时游码位置如图乙):再用量筒称取10mL蒸馏水,将粗盐和蒸馏水转移到烧杯中,用玻璃棒搅拌,使粗盐充分溶解.
(2)过滤
③制作过滤器,并进行过滤操作,然后仔细观察过滤纸上的剩余物质及滤液的颜色.
④一开始时,乐乐小组同学的过滤操作(如图丙).
请将其中的错误之处加以指正:没有玻璃棒引流.
⑤老师发现红红同学过滤的速度明显比其它的小组要慢,分析其中可能的原因是:滤纸和漏斗壁之间有气泡.
(3)蒸发
将过滤后所得的溶液转移后进行蒸发(如图丁),待出现较多固体时,停止加热,利用余热将滤液蒸干.
⑥盛装滤液的仪器甲的名称是蒸发皿.
⑦玻璃棒所起的作用是使液体均匀受热,防止局部温度过高,造成液滴飞溅.
(4)计算产率
蒸发操作结束后,用玻璃棒将固体转移到纸片上,比较食盐提纯前后的状态,称量提纯后的食盐(精盐)的质量为1.7g.最后将固体回收到指定的容器中.
⑧精盐产率(%)的计算过程和结果=85%.
【拓展提升】
(5)物质溶解情况可以定量表示,现提供氯化钠和硝酸钾的溶解度数据如表所示.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 | |
⑩在化学上,分离物质有多种方法.欲使某温度下的硝酸钾饱和溶液中的硝酸钾析出,你认为可能的方法有冷却热饱和溶液(降温结晶),若从硝酸钾和氯化钠(少量)的混合物中分离出硝酸钾,你的实验方案是:先制成高温下的硝酸钾饱和溶液,再冷却,过滤.
(6)“粗盐的初步提纯”实验中得到的精盐并不是纯净物,还含有少量可溶性的杂质.若要除去其中含有的Mg2+、Ca2+、和硫酸根,依次加入下列试剂(每一步都过量)并采取相应的实验操作手段,能够达到实验目的是:BD.
A.BaCl2、NaOH、Na2CO3、H2SO4
B,BaCl2、NaOH、Na2CO3、HCl
C.Na2CO3、BaCl2、NaOH、HCl
D.NaOH、BaCl2、Na2CO3、HCl.
【提出问题】溶液中的溶质是什么物质?
【作出猜想】
(1)甲同学认为溶液中的溶质只有Na2SO4一种物质.
(2)乙同学认为溶液中的溶质是Na2SO4和硫酸两种物质.
(3)丙同学认为溶液中的溶质是Na2SO4和NaOH两种物质.
【查阅资料】①Na2SO4溶液显中性.
②Al与强碱NaOH溶液(NaOH和H2O)反应生成偏铝酸钠(NaAlO2)等物质.
【实验验证】
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学 实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
| 丙同学 实验 | 取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液 | 溶液变红色 | 猜想(3)成立 |
【知识拓展】(1)生活中能否用铝制品来盛放强碱性溶液?不能(填“能”或“不能”)
(2)乙同学的实验中铝片与氢氧化钠溶液发生了反应,请写出铝与该溶液发生反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
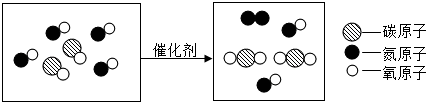
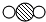 中“
中“ ”与“
”与“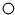 ”的质量比是3:8(填最简整数比).
”的质量比是3:8(填最简整数比).
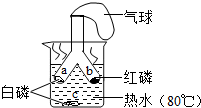 如图所示为探究燃烧条件的实验方案.将白磷和红磷分装于Y形管的两支管中,管口牢系小气球,将两支管同时深入热水中.
如图所示为探究燃烧条件的实验方案.将白磷和红磷分装于Y形管的两支管中,管口牢系小气球,将两支管同时深入热水中.