题目内容
14.黄铜矿(主要成分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3,CuSO4及H2SO4.某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜.主要步骤如图1所示.
(1)步骤Ⅰ中,生成铜的化学方程式:Fe+CuSO4=Cu+FeSO4.
(2)Fe2(SO4)3与铁反应的化学方程式:xFe2(SO4)3+yFe═zFeSO4,其中x、y、z为化学计量数,z的值为3.
(3)步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是Na2CO3(填化学式).
(4)步骤Ⅲ需加入的试剂是H2SO4(填化学式).
(5)在实验室里,有同学完成了以下实验:将等质量的镁、铁、锌三种金属分别放入三份溶液质量和溶质质量分数均相等的稀盐酸中,生成H2的质量与反应时间的关系如图2所示,则金属X是Mg(填化学式,下同),肯定有剩余的金属是Mg、Fe.
分析 (1)根据铁和硫酸铜反应生成硫酸亚铁和铜进行分析;
(2)根据质量守恒定律进行分析;
(3)根据碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠进行分析;
(4)根据不溶物中含有置换出的铜和反应剩余的铁进行分析;
(5)根据金属的活动性以及反应原理来分析.
解答 解:(1)溶液甲中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;故填:Fe+CuSO4=Cu+FeSO4;
(2)通过分析xFe2(SO4)3+yFe=zFeSO4可知,依据化合价的升降,将方程式配平,所以Fe2(SO4)3+2Fe=3FeSO4,z的值为3;故填:3;
(3)碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠;故填:Na2CO3;
(4)通过推导可知,不溶物中含有置换出的铜和反应剩余的铁,所以步骤Ⅲ回收铜的方法为:加入过量的稀硫酸,过滤、洗涤、干燥.故填:H2SO4;
(5)因为镁最活泼,反应时间少,则图线X表示镁的反应情况,因为三种金属生成的氢气质量相等,结合生成的氢气质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属质量,可知:锌可能反应完,镁、铁一定过量,故填:Mg;Mg、Fe.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答.金属与酸反应的有关知识,综合性较强,不仅需要根据图象和题意分析出直接信息,还需要根据计算得出用量问题.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
5.对人体吸入的空气和呼出气体的探究
[结论]人呼出的气体比吸入气体含量变多的气体是二氧化碳、水蒸气,变少的是氧气.
| 探究步骤 | 现象 | 分析或结论 | |
| 1、用排水法收集两瓶呼出的气体 | |||
| 2、 检 验 气 体 的 组 成 | (1)取一瓶空气和一瓶呼出的气体,分别滴入澄清石灰水 | 空气:石灰水无明显变化 呼出气体:石灰水变浑浊 | 呼出气体中CO2 的含量比空气中多 |
| (2)空气和一瓶呼出的气体,分别插入燃着的小木条 | 空气:木条燃烧无明显变化 呼出气体:木条熄灭 | 呼出气体中O2含量比空气中少 | |
| (3)两块干燥的玻璃片,对其中的一块呼气 | 呼出的一块上可看到: 水雾 | 呼出气体中水分含量比空气中多 | |
2.为弄清实验室里一瓶久置的熟石灰是否部分变质,小明进行了实验探究.请帮小明同学完成实验探究报告.
【提出问题】熟石灰样品是否部分变质?
【猜 想】熟石灰样品已部分变质.其依据是CO2+Ca(OH)2═CaCO3↓十H2O (用化学方程式表示):
【实验仪器与药品】胶头滴管、试管、熟石灰样品、水、酚酞试液、稀盐酸.
【探究过程】
【探究结论】小明的猜想不正确 (填“正确”或“不正确”).
【提出问题】熟石灰样品是否部分变质?
【猜 想】熟石灰样品已部分变质.其依据是CO2+Ca(OH)2═CaCO3↓十H2O (用化学方程式表示):
【实验仪器与药品】胶头滴管、试管、熟石灰样品、水、酚酞试液、稀盐酸.
【探究过程】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品加入试管中,加适量的水,振荡,然后滴加酚酞试液 | 溶液变红色 | 样品中存在Ca(OH)2 |
| ②另取少量样品加入另一试管中,然后滴加HCl(或盐酸). | 无气泡产生 | 样品中不存在CaCO3 |
4.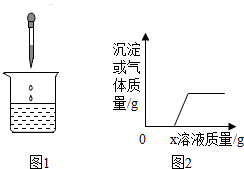 向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
 向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )| 烧杯中的物质 | x溶液 | |
| A | 氯化钠和碳酸氢钠溶液 | 稀盐酸 |
| B | 需硫酸和稀盐酸 | 氯化钡溶液 |
| C | 黄铜粉末 | 稀盐酸 |
| D | 稀盐酸和硫酸镁溶液 | 烧碱溶液 |
| A. | A | B. | B | C. | C | D. | D |

 如图是某同学制作的简易净水器,请回答下列问题:
如图是某同学制作的简易净水器,请回答下列问题: