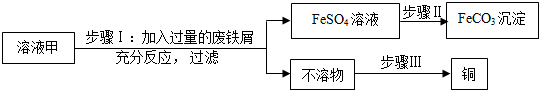
题目内容
2.向质量为8.4g的MgCO3和NaHCO3的混合物中,加入100g稀盐酸,恰好完全反应后,得到二氧化碳的质量是4.4g.下列说法正确的是( )| A. | 混合物中MgCO3和NaHCO3的质量比一定是1:1 | |
| B. | 所加稀盐酸的溶质质量分数可能为5% | |
| C. | 混合物中MgCO3和NaHCO3无论以任何比例混合,消耗此稀盐酸的总质量均为100g | |
| D. | 混合物中MgCO3和NaHCO3无论以任何比例混合,生成二氧化碳的总质量均为4.4g |
分析 根据MgCO3+2HCl═MgCl2+CO2↑+H2O、NaHCO3+HCl═NaCl+CO2↑+H2O可看出:MgCO3和NaHCO3与稀盐酸反应的方程式中,MgCO3和NaHCO3与二氧化碳的质量比相同,即混合物中MgCO3和NaHCO3可以以任意比混合.
解答 解:
A、根据MgCO3+2HCl═MgCl2+CO2↑+H2O、NaHCO3+HCl═NaCl+CO2↑+H2O可看出:
MgCO3和NaHCO3与二氧化碳的质量比都是84:44,即混合物中MgCO3和NaHCO3可以以任意比混合,故错误;
B、利用极值法,设MgCO3需要的HCl为x
由MgCO3+2HCl═MgCl2+CO2↑+H2O
73 44
x 4.4g
$\frac{73}{x}=\frac{44}{4.4g}$
x=7.3g
盐酸中溶质的质量分数是$\frac{7.3g}{100g}$×100%=7.3%
设NaHCO3需要的HCl为y
NaHCO3+HCl═NaCl+CO2↑+H2O
36.5 44
y 4.4g
$\frac{36.5}{y}=\frac{44}{4.4g}$
y=3.65g
盐酸中溶质的质量分数是$\frac{3.65g}{100g}$×100%=3.65%
所以盐酸中溶质的质量分数在3.65%和7.3%之间,故正确;
C、由反应的方程式可知:混合物中MgCO3和NaHCO3无论以任何比例混合,消耗此稀盐酸的总质量不相等,故错误;
D、MgCO3和NaHCO3与稀盐酸反应的方程式中,MgCO3和NaHCO3与二氧化碳的质量比相同,即混合物中MgCO3和NaHCO3可以以任意比混合,生成二氧化碳的总质量均为4.4g,故正确;
答案:BD
点评 此题乍看似乎摸不着头脑,但仔细审题就可发现MgCO3和NaHCO3与稀盐酸反应的方程式中,MgCO3和NaHCO3与二氧化碳的质量比相同,以此为突破口,此题就会迎刃而解.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案| A. | 50ml酒精和50ml水混合后体积小于100ml,是因为分子间有间隙 | |
| B. | 墙内开花墙外香是因为分子是运动的 | |
| C. | 气体受热膨胀是因为分子的体积增大 | |
| D. | 水电解因为分子发生改变 |
| A. | 生活中常用的塑料、纤维、合金等都是有机合成材料 | |
| B. | 缺锌会引起食欲不振,生长迟缓,发育不良.因此我们要大量补充葡萄糖酸锌 | |
| C. | 葡萄糖在人体内缓慢氧化,同时放出能量 | |
| D. | 脂肪、糖类、动物蛋白都是人体必须的营养素,吃得越多越好 |
| A. | 硬水和软水可以用石蕊试液来区分 | |
| B. | 常用吸附、沉淀、过滤、蒸馏等方法净化水 | |
| C. | 水变成水蒸气时体积增大是因为水分子体积变大 | |
| D. | 所有溶液中的溶剂均为水 |
 如图是化肥硝酸铵包装袋上的部分说明,在硝酸铵中氧元素质量分数最高,硝酸铵应具有的性质是易溶于水(或受热易分解)(写出一条即可).
如图是化肥硝酸铵包装袋上的部分说明,在硝酸铵中氧元素质量分数最高,硝酸铵应具有的性质是易溶于水(或受热易分解)(写出一条即可). 2014年3月8日凌晨,马来西亚航空公司一架载有239人(其中154名中国人)的客机在飞往北京的途中突然失踪,引起全世界的关注,多个国家参与搜索,其中飞机“黑匣子”(名为航空飞行记录器)是搜寻的重点之一.制取“黑匣子”的材料之一是金属钛,钛具有硬度大、密度小、熔点高、抗腐蚀性远优于不锈钢等优良性能,地球表面富含钛铁矿石,钛铁矿石的主要成分是FeTiO3.请回答:
2014年3月8日凌晨,马来西亚航空公司一架载有239人(其中154名中国人)的客机在飞往北京的途中突然失踪,引起全世界的关注,多个国家参与搜索,其中飞机“黑匣子”(名为航空飞行记录器)是搜寻的重点之一.制取“黑匣子”的材料之一是金属钛,钛具有硬度大、密度小、熔点高、抗腐蚀性远优于不锈钢等优良性能,地球表面富含钛铁矿石,钛铁矿石的主要成分是FeTiO3.请回答: