题目内容
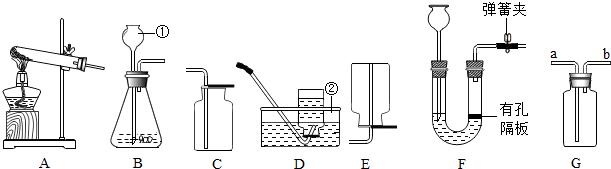
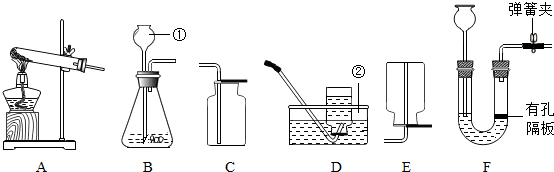
8. 某同学设计了测定空气中氧气含量的实验,实验装置如图.
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
①将图中的集气瓶分为5等份,并作好标记.
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.
③充分反应后,待集气瓶冷却至室温,打开止水夹.
请回答下列问题:
(1)该实验中红磷需稍过量,目的是耗尽集气瓶内空气中的氧气.
(2)步骤③中打开止水夹后观察到的现象烧杯中的水进入集气瓶中,集气瓶中的水面上升,约占总体积的五分之一,由此可得出的结论是空气中的氧气约占空气总体积的$\frac{1}{5}$.
(3)某同学将红磷换成木炭,结果实验未能获得成功,你认为理由是木炭燃烧生成了二氧化碳气体,不能使瓶中压强出现明显的变化.
(4)若实验后测得的结果偏小(即空气中氧气的含量小于$\frac{1}{5}$),产生的原因可能是(任写一条)红磷的量不足(或装置的气密性不好或没有冷却就打开止水夹等).
(5)写出这个实验所涉及到的化学反应的表达式:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
分析 (1)根据红磷燃烧消耗氧气,生成五氧化二磷固体进行解答;
(2)根据红磷的燃烧结合压强知识分析,红磷与氧气反应生成固体,消耗了瓶内的气体,压强减小,外界大气压会压着水进入集气瓶;
(3)根据木炭燃烧的产物结合压强知识进行解答;
(4)根据实验的注意事项进行解答;
(5)根据化学方程式的书写方法、步骤进行书写即可.
解答 解:(1)实验的目的是测定空气中氧气含量,原理是消耗氧气使装置内外产生压强差,水被吸入占据氧气的空间,从而达到测定氧气的目的,红磷过量,可使集气瓶中的氧气完全消耗;故答案为:耗尽集气瓶内空气中的氧气;
(2)红磷与氧气反应,生成了五氧化二磷固体,所以会导致集气瓶内压强减小,水被压入集气瓶,进入的水量正好占据集气瓶内氧气的空间,约为集气瓶体积的五分之一;据实验现象可得出空气中的氧气约占空气总体积的$\frac{1}{5}$;故答案为:烧杯中的水进入集气瓶中,集气瓶中的水面上升,约占总体积的五分之一;空气中的氧气约占空气总体积的$\frac{1}{5}$;
(3)木炭燃烧生成了二氧化碳气体,不能使瓶中压强出现明显的变化,所以实验失败;故答案为:木炭燃烧生成了二氧化碳气体,不能使瓶中压强出现明显的变化;
(4)如果该实验水位小于$\frac{1}{5}$,出现误差的原因可能是红磷的量不足、装置的气密性不好、没有冷却就打开止水夹.故答案为:红磷的量不足、装置的气密性不好、没有冷却就打开止水夹;
(5)红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5,故答案为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
点评 选择消耗氧气的物质时,应该是该物质只能够和空气中的氧气反应,生成物是固体,并且要足量;熟记用红磷测定空气里氧气含量的实验原理、操作步骤、实验现象、实验结论和注意事项是解答这类题目的基础.

 水和溶液在生命活动和生产、生活中起着十分重要的作用.
水和溶液在生命活动和生产、生活中起着十分重要的作用.(1)“生命吸管”(如图)是一种可以随身携带的小型水净化器,里面装有网丝、注入了活性炭和碘的树脂等.其中活性炭起到吸附和过滤的作用.
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为KNO3.
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种.现将300g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为200g.
(4)根据下表回答问题.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液.下列说法正确的是D(填字母序号)
A.溶质的质量不变 B.溶液中溶质的质量分数一定减小
C.溶液质量可能不变 D.可升高温度或增加溶剂.

| A. | 该反应中有两种化合物 | |
| B. | 反应前后各种元素的化合价都不变 | |
| C. | 该反应属于化合反应 | |
| D. | 参加反应的甲和乙分子个数比为4:1 |
 如图所示是实验室制取氢气的一种简易装置图,根据装置回答问题:
如图所示是实验室制取氢气的一种简易装置图,根据装置回答问题: