题目内容
17.已知碳酸钙在高温下可分解生成氧化钙和二氧化碳,现有含杂质10%的石灰石(主要成分为碳酸钙,其他杂质不参与反应)100t,经高温锻烧后,测得剩余固体的质量为78t.通过计算回答:(1)生成二氧化碳的质量为22t
(2)石灰石中的碳酸钙是否完全分解?(写出计算过程)
分析 碳酸钙在高温下可分解生成氧化钙和二氧化碳,根据反应写出反应的方程式.根据质量守恒定律,固体减少的质量就是生成的二氧化碳的质量,由二氧化碳的质量,根据反应的方程式求出碳酸钙的.
解答 解:(1)由于碳酸钙在高温下可分解生成氧化钙和二氧化碳,固体减少的质量就是生成的二氧化碳的质量,为:100t-78t=22t
设分解的碳酸钙的质量为x
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 44
x 22t
$\frac{100}{x}=\frac{44}{22t}$
解得:x=50t
石灰石中碳酸钙的质量为:100t×(1-10%)=90t;
故石灰石中的碳酸钙没有完全分解.
答:(1)22;
(2)石灰石中的碳酸钙没有完全分解.
点评 学会运用质量守恒定律这一原理来分析并解决问题,本题中结合质量守恒定律分析得到生成二氧化碳的质量,是解决问题的基础,也体现分析问题的能力.

练习册系列答案
相关题目
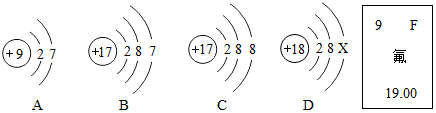
7.下列粒子在人体中起着重要的作用,其中属于阴离子的是( )
| A. |  | B. |  | C. |  | D. |  |
12.下列各组物质分别置于密闭容器中,在一定条件下充分反应后,密闭容器中的气态物质为纯净物的是( )
| A. | 分子数比为1:1的H2和Cl2 | B. | 分子数比为1:1的CO和O2 | ||
| C. | 质量比为1:5的CH4和O2 | D. | 质量比为1:3的C和O2 |
7.t2℃时,将甲、乙固体各W g (不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,降温到t1℃时现象如图2(水分不蒸发),甲、乙固体的溶解度曲线如图3.

下列说法正确的是( )

下列说法正确的是( )
| A. | 图3中M表示的是乙的溶解度曲线 | |
| B. | 图2中甲溶液一定饱和,乙溶液一定饱和 | |
| C. | 图2乙溶液一定比甲溶液浓 | |
| D. | 当W=50g时,甲、乙溶液溶质质量分数一定相等 |
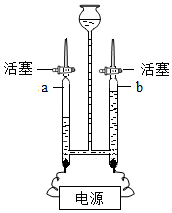 如图为探究水的组成的实验装置,请回答下列问题.
如图为探究水的组成的实验装置,请回答下列问题. (1)请你在编号①、⑤处填入一种物质:①是酚酞,⑤是氯化钙.
(1)请你在编号①、⑤处填入一种物质:①是酚酞,⑤是氯化钙.