题目内容
13.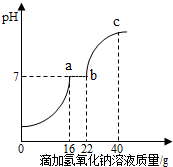 在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为lO%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如下图所示的关系.
在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为lO%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如下图所示的关系.(1)该实验过程中观察到的现象氢氧化钠溶液滴加到16毫升时开始产生沉淀,继续滴加至22毫升以上时沉淀不再增加.
(2)写出a-b段发生反应的化学方程式FeCl3+3NaOH=3NaCl+Fe(OH)3↓.
(3)c点所得溶液中溶质为NaCl、NaOH.
(4)求该工业盐酸中氯化氢的溶质质量分数(写出计算过程,结果精确至0.1%).
分析 在盐酸存在的条件下,氢氧化钠不能和氯化铁反应,所以只有把盐酸消耗掉之后,才会生成沉淀,从图中可知0-a段为氢氧化钠与盐酸反应,a-b段为氢氧化钠与氯化铁反应,b-c段氢氧化钠过量,据此解答.
解答 解:(1)从图中可知0-a段为氢氧化钠与盐酸反应,a-b段为氢氧化钠与氯化铁反应,b-c段氢氧化钠过量,故:氢氧化钠溶液滴加到16毫升时开始产生沉淀,继续滴加至22毫升以上时沉淀不再增加;
故填:氢氧化钠溶液滴加到16毫升时开始产生沉淀,继续滴加至22毫升以上时沉淀不再增加;
(2)a-b段为氢氧化钠与氯化铁反应,化学方程式为:FeCl3+3NaOH=3NaCl+Fe(OH)3↓;
故填:FeCl3+3NaOH=3NaCl+Fe(OH)3↓;
(3)b-c段氢氧化钠过量,故溶液中的溶质为:NaCl、NaOH;
故填:NaCl、NaOH;
(4)解:设其中氯化氢的质量为x
HCl+NaOH=NaCl+H20
36.5 40
x 16g×10%
$\frac{36.5}{40}=\frac{x}{16g×10%}$
X=l.46g
盐酸中氯化氢的质量分数为$\frac{1.46g}{20g}$×100%=7.3%
答:工业盐酸中氯化氢的质量分数为7.3%.
点评 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识按照题目要求进行认真地选择或解答即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列有关某些实验的说法中,正确的是( )
| A. | 做除杂和检验的实验时,都必须取样,否则引进杂质 | |
| B. | 点燃可燃性气体时,要先检验纯度,否则可能发生爆炸 | |
| C. | 称量氢氧化钠固体时,必须将氢氧化钠放在纸上,否则发生潮解 | |
| D. | 做细铁丝在氧气里燃烧的实验时,必须用排水法收集氧气,否则铁丝不燃烧 |
1.下列归纳和总结完全正确的一组是( )
| A、对鉴别方法的认识 | B、对安全的认识 |
| ①区分硬水和软水,加肥皂水后搅拌 ②区分棉纤维和羊毛纤维,点燃后闻气味 ③区分硫酸铵和硫酸钾,加熟石灰粉末研磨 | ①点燃可燃性气体前一定要验纯 ②煤矿矿井要保持通风、严禁烟火 ③生产面粉、铁粉的工厂不必禁火 |
| C、对现象的认识 | D、对防锈的认识 |
| ①气体压缩,是因为气体分子之间的间隔变小 ②柠檬汁使紫色石蕊试液变红,是因为柠檬汁呈酸性 ③喝汽水打嗝,是因为气体溶解度随温度升高而增大 | ①自行车的支架喷油漆防锈 ②保留铁锈可防止铁进一步锈蚀 ③菜刀用后及时洗净擦干 |
| A. | A | B. | B | C. | C | D. | D |
8. 如表是固体A的溶解度.向100g水 中不断加入固体A或改变温度,得到相应的溶液①~⑤.请回答:
如表是固体A的溶解度.向100g水 中不断加入固体A或改变温度,得到相应的溶液①~⑤.请回答:

(1)根据表中数据画出A从20℃至60℃的溶解度曲线:
(2)在①②③④⑤中,一定是饱和溶液的是②⑤(填数字);
(3)在①②③④⑤中,A的质量分数相等是D(填字母).
A.①和②B.②和③C.③和④D.④和⑤
 如表是固体A的溶解度.向100g水 中不断加入固体A或改变温度,得到相应的溶液①~⑤.请回答:
如表是固体A的溶解度.向100g水 中不断加入固体A或改变温度,得到相应的溶液①~⑤.请回答:| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| A溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |

(1)根据表中数据画出A从20℃至60℃的溶解度曲线:
(2)在①②③④⑤中,一定是饱和溶液的是②⑤(填数字);
(3)在①②③④⑤中,A的质量分数相等是D(填字母).
A.①和②B.②和③C.③和④D.④和⑤
18.在AgNO3、Zn(NO3)2和Cu(NO3)2的混合溶液中加人一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生.根据上述现象,下列结论正确的是( )
| A. | 滤渣中一定有Zn | B. | 滤渣中可能有Ag、Cu | ||
| C. | 滤液中可能有AgNO3、Cu(NO3)2 | D. | 滤液中一定有Fe(NO3)2、Zn(NO3)2 |
 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.
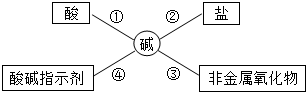 为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请完成下列问题.
为了便于理解和记忆,小丽同学总结了碱的化学性质如图,请完成下列问题.