题目内容
2.酒后驾驶会对人民生命财产造成极大的伤害,原因是:酒精会导致触觉能力、判断能力和操作能力降低,反应能力下降.酒精的化学式为:C2H5OH.(1)酒精属于有机物(填“单质”“化合物”“合金”或“有机物”)
(2)酒精中C、H、O原子个数比为2:6:1.
(3)酒精中氧元素的质量分数为34.8%(计算结果精确到0.1%)
分析 (1)根据含有碳元素的化合物叫有机化合物分析解答;
(2)根据1个乙醇分子的构成进行分析;
(3)根据元素的质量分数的计算方法进行解答;
解答 解:(1)酒精是含有碳元素的化合物,所以属于有机物;
(2)1个乙醇分子是由2个碳原子、6个氢原子和1个氧原子构成的,则乙醇分子中C、H、O原子个数比为2:6:1;
(3)乙醇中氧元素的质量分数为:$\frac{16}{12×2+1×6+16}$×100%=34.8%;
故答案为:(1)有机物;(2)2:6:1;(3)34.8%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
13.如图为某一反应的微观示意图.下列叙述正确的是( )


| A. | 该反应中原子个数变少 | B. | 反应前后分子个数不变 | ||
| C. | 反应前后各元素的化合价均不变 | D. | 反应过程中A与D的质量比为8:3 |
10.某同学在参观济南奥体中心时,看到以下情境:①路灯使用太阳能发电;②场地配备交通电瓶车;③就地焚烧垃圾;④植树种花,搞好绿化.你认为其中有利于保护环境和节约能源的做法有( )
| A. | 只有①②④ | B. | 只有③ | C. | 只有①④ | D. | 只有①② |
17.下列微粒结构示意图中,表示阴离子的是( )
| A. |  | B. |  | C. |  | D. |  |
12.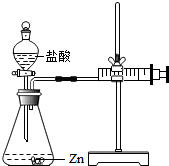 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同浓度和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Zn+2HCl=ZnCl2+H2↑、Fe+2HCl=FeCl2+H2↑;.从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属活动性越强,反应的程度越剧烈.
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是量取生成气体的体积.所用药品,实验数据如表:
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是盐酸浓度越大,反应程度越剧烈.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积.(写出一条即可)
【拓展延伸】很多金属不仅能与酸反应,也能与盐溶液反应,将铁棒放入硫酸铜溶液中,在铁棒上析出红色物质,过一段时间后,取出铁棒称量,发现质量比原来增加4g,则生成铜的质量为32g.
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同浓度和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Zn+2HCl=ZnCl2+H2↑、Fe+2HCl=FeCl2+H2↑;.从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属活动性越强,反应的程度越剧烈.
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是量取生成气体的体积.所用药品,实验数据如表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积.(写出一条即可)
【拓展延伸】很多金属不仅能与酸反应,也能与盐溶液反应,将铁棒放入硫酸铜溶液中,在铁棒上析出红色物质,过一段时间后,取出铁棒称量,发现质量比原来增加4g,则生成铜的质量为32g.

 ”表示一个氢原子,则“
”表示一个氢原子,则“ ”表示H2(填写物质化学式),从图2中可知,汞的核电荷数是80;
”表示H2(填写物质化学式),从图2中可知,汞的核电荷数是80; 通过如图微观模拟化学反应示意图回答下列问题.
通过如图微观模拟化学反应示意图回答下列问题.
