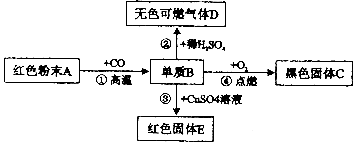
题目内容
19.某河道两旁有甲、乙两工厂,它们排放的工业废水中含有CuSO4、KOH、Ba(NO3)2、K2SO4、Mg(NO3)2五种物质,且甲、乙两厂排放的河水中所含物质各不相同.回答下列问题:(1)已知甲厂的废水中含有三种物质,则乙厂废水中所含物质应该是KOH和 Ba(NO3)2;
(2)将甲、乙两厂的废水按适当比例混合,可以使废水中的某些有害离子转化为沉淀,经过滤后的废水中含有能作为复合肥料的物质是KNO3;产生这种物质的化学方程式是:Ba(NO3)2+K2SO4=BaSO4↓+2KNO3【或2KOH+Mg(NO3)2=2KNO3+Mg(OH)2↓】(任写一个).
分析 根据复分解反应的实质进行分析,在溶液中若离子间能结合生成沉淀、气体或水,则离子不能共存.这五种物质中Ba(NO3)2与CuSO4、K2SO4、不能共存;KOH与CuSO4;Mg(NO3)2不能共存.
解答 解:(1)根据上述五种物质,Ba(NO3)2与CuSO4、K2SO4、不能共存;因结合成硫酸钡沉淀,即硫酸铜和硫酸钾在同一厂,KOH与CuSO4;Mg(NO3)2不能共存.能相互结合成氢氧化铜、氢氧化镁沉淀,故硫酸铜和硝酸镁在同一厂,又知甲厂废水中含有三种物质,这三种物质是CuSO4、K2SO4、Mg(NO3)2,则乙厂废水中所含物质是KOH、Ba(NO3)2;
(2)若将两厂的废水按适当比例混合,可将Ba2+、Mg2+、Cu2+、OH-、SO42-转化为沉淀,经过滤后水中主要含有KNO3;KNO3是一种含钾和氮两种营养元素的复合肥;硫酸钾与硝酸钡反应生成硫酸钡沉淀和硝酸钾,硝酸镁与氢氧化钾反应生成硝酸钾和氢氧化镁沉淀.
故答案为:
(1)KOH和 Ba(NO3)2 ;
(2)KNO3;Ba(NO3)2+K2SO4=BaSO4↓+2KNO3【或2KOH+Mg(NO3)2=2KNO3+Mg(OH)2↓】.
点评 本题考查了常见物质或离子的共存问题,完成此题,可以依据复分解反应的实质进行,要求同学们熟记常见的酸碱盐在水中的溶解性,以便灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.如图所示为实验室常见气体制备、净化、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器).某学校两个化学实验探究小组的同学,欲用下列仪器完成各自的探究实验.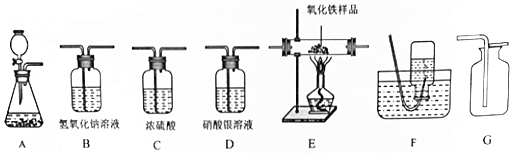
(1)第一组的同学用过氧化氢溶液和二氧化锰 制取氧气.
①制取并收集一瓶干燥的氧气,所选仪器的连接顺序为ACG(填写仪器序号字母).
②用过氧化氢溶液和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③制取气体前,需要检查仪器A的气密性,其具体操作步骤是关闭阀门,将导管一端放入水中,用水捂住锥形瓶,一段时间后,若水中的导管口有气泡冒出,手松开,水会倒流进导管口一段距离,则说明气密性良好.
(2)第二组同学欲用一种混合气体(可能含有H2、CO、H2O、HCl中的一种或几种),测定某10g氧化铁样品中的氧化铁的质量分数.实验时,所选仪器的连接顺序是“混合气体→D→C1→E→C2→B→碱石灰干燥管”,样品充分反应,测定部分装置反应前后的质量变化,并绘制了如下表格(假设样品中杂质不挥发,也不发生化学反应:已知:Fe2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O).
请回答下列问题:
①装置E中能观察到的明显现象是红色固体变黑.
②装置B中发生反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
③根据以上现象判断,混合气体中一定不存在的气体是氯化氢(填物质名称).
④该氧化铁样品中氧化铁的质量分数是88%.

(1)第一组的同学用过氧化氢溶液和二氧化锰 制取氧气.
①制取并收集一瓶干燥的氧气,所选仪器的连接顺序为ACG(填写仪器序号字母).
②用过氧化氢溶液和二氧化锰制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
③制取气体前,需要检查仪器A的气密性,其具体操作步骤是关闭阀门,将导管一端放入水中,用水捂住锥形瓶,一段时间后,若水中的导管口有气泡冒出,手松开,水会倒流进导管口一段距离,则说明气密性良好.
(2)第二组同学欲用一种混合气体(可能含有H2、CO、H2O、HCl中的一种或几种),测定某10g氧化铁样品中的氧化铁的质量分数.实验时,所选仪器的连接顺序是“混合气体→D→C1→E→C2→B→碱石灰干燥管”,样品充分反应,测定部分装置反应前后的质量变化,并绘制了如下表格(假设样品中杂质不挥发,也不发生化学反应:已知:Fe2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O).
| 装置编号 | D | C1 | C2 | B |
| 试剂 | 硝酸银溶液 | 浓硫酸 | 浓硫酸 | 氢氧化钠溶液 |
| 现象或质量变化 | 无明显现象 | 增重1.0g | 增重2.7g | 增重0.66g |
①装置E中能观察到的明显现象是红色固体变黑.
②装置B中发生反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
③根据以上现象判断,混合气体中一定不存在的气体是氯化氢(填物质名称).
④该氧化铁样品中氧化铁的质量分数是88%.
10.实验室若用加热高锰酸钾的方法制取氧气,并用排水法收集,检查装置的气密性,向试管内加完药品后,接下来的四步实验操作顺序正确的是( )
①用酒精灯加热;
②将试管固定在铁架台上;
③将集气瓶装满水并倒扣在水槽内;
④待产生的气泡均匀连续时,将导气管伸入集气瓶内开始收集.
①用酒精灯加热;
②将试管固定在铁架台上;
③将集气瓶装满水并倒扣在水槽内;
④待产生的气泡均匀连续时,将导气管伸入集气瓶内开始收集.
| A. | ①③②④ | B. | ③②①④ | C. | ②①③④ | D. | ①②③④ |
7.下列化学用语中,书写不正确的是( )
| A. | 2个氢离子2H+ | B. | 氧化钙中钙元素的化合价$\stackrel{+2}{Ca}$O | ||
| C. | 五氧化二磷P2O5 | D. | 硫酸铝AlSO4 |
14.下列各组离子在水中能大量共存的是( )
| A. | Na+、H+、Cl-、HCO3- | B. | K+、Na+、Cl-、NO3- | ||
| C. | H+、Na+、OH-、SO42- | D. | Ag+、Ca2+、NO3-、Cl- |
4.取用液体药品时,如果没有说明用量,一般应按最少量取用,液体为( )
| A. | 0.5 mL | B. | 1~2 mL | ||
| C. | 铺满试管底部即可 | D. | 10 mL |