题目内容
6.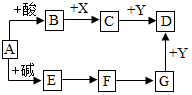 如图是初中化学常见物之间的转化关系(反应条件和部分产物已略去),其中A为钠盐,X、Y均为黑色粉末,D为红色金属单质,F在常温下为液态,试回答下列问题:
如图是初中化学常见物之间的转化关系(反应条件和部分产物已略去),其中A为钠盐,X、Y均为黑色粉末,D为红色金属单质,F在常温下为液态,试回答下列问题:( l )若A含三种元素,则A的俗名是纯碱或苏打;若A含四种元素,则A的化学式为NaHCO3.
(2)若E→F为中和反应,则E的化学式是NaOH
(3)B→C的化学方程式为CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO
(4)写出上述物质转化过程中属于分解反应的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
分析 本题属于推断题,根据题目给出的流程图和信息:A为钠盐,若A含三种元素,则A是碳酸钠,它的俗名是纯碱或苏打;若A含四种元素,则A碳酸氢钠;若E→F为中和反应,氢氧化钠和盐酸反应生成氯化钠和水,因此E是氢氧化钠,F是水;水在通电的条件下生成氢气和氧气,G是氢气;碳酸钠和盐酸反应生成氯化钠和水和二氧化碳,二氧化碳和碳在高温的条件下生成一氧化碳,因此B是二氧化碳,C是一氧化碳;D为红色金属单质,D是铜.
解答 解:(1)根据题目给出的流程图和信息:A为钠盐,若A含三种元素,则A是碳酸钠,它的俗名是纯碱或苏打;若A含四种元素,则A碳酸氢钠;故答案为:纯碱或苏打;NaHCO3;
(2)若E→F为中和反应,氢氧化钠和盐酸反应生成氯化钠和水,因此E是氢氧化钠;故答案为:NaOH;
(3)二氧化碳和碳在高温的条件下生成一氧化碳,配平即可;故答案为:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
(4)水在通电的条件下生成氢气和氧气,配平即可,属于分解反应;故答案为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
点评 本考点属于物质的推断题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.本考点是中考的重要内容之一,一般有两种类型:一是图框式推断题;二是文字描述型推断题;本题属于第一种类型.不论哪一种类型,都是通过实验现象,从而得出物质的组成.此考点主要出现在填空题和实验题中.

练习册系列答案
相关题目
18.碳-14原子核中含6个质子与8个中子,生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变),在衰变时,一个中子变成1个质子,形成新的原子核.因此科学家可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代,这种方法称之为放射性碳测年法.下列关于衰变后的新原子核的说法正确的是( )
| A. | 碳原子核,含7个质子,8个中子 | B. | 氧原子核,含7个质子,8个中子 | ||
| C. | 碳原子核,含6个质子,7个中子 | D. | 氮原子核,含7个质子,7个中子 |
15.积雪撒盐可以融雪,但是易造成土壤中食盐浓度偏高,造成周边树木死亡.现已研究出一种新型融雪剂,既能融化冰雪,又能起施肥养护树木的作用.请你猜测具有上述作用的新型融雪剂是( )
| A. | NaCl、CaCl2 | B. | Ca(NO3)2Mg(NO3)2 | C. | NaCl Ca(OH)2 | D. | CaCl2MgCO3 |
16.下列关于空气的说法不正确的是( )
| A. | 空气中含量最多的是氮气 | |
| B. | 通过实验测定了空气的组成的科学家是门捷列夫 | |
| C. | 空气中O2仍然保持原有的化学性质 | |
| D. | N2、O2的体积比约为4:1 |

 自行车是人们常用的交通工具.根据如图回答下列问题:
自行车是人们常用的交通工具.根据如图回答下列问题: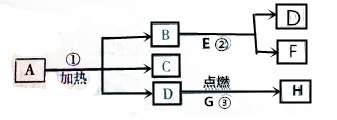 A.B…H八种物质,有下图所示关系:其中G是生活中常见的金属,在②的反应前后B的质量和化学性质都不改变,且E和F的组成元素相同.试判断:
A.B…H八种物质,有下图所示关系:其中G是生活中常见的金属,在②的反应前后B的质量和化学性质都不改变,且E和F的组成元素相同.试判断: