题目内容
精盐(NaCl)和纯碱(Na2 C03)是两种常见之物.
(1)用化学方法区别这两种固体,可以选择下列哪一种物质?答:
A.白酒 B.米醋 C.纯净水 D.酱油
(2)王军同学不慎在精盐中混入了少量纯碱,他想重新得到精盐,设计了以下两个实验方案:
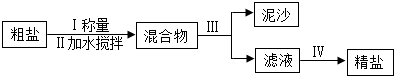
方案一:固体混合物
溶液
固体
方案二:固体混合物
溶液
固体
你认为合理的实验方案是
说明另一方案不合理的理由:
(1)用化学方法区别这两种固体,可以选择下列哪一种物质?答:
B
B
A.白酒 B.米醋 C.纯净水 D.酱油
(2)王军同学不慎在精盐中混入了少量纯碱,他想重新得到精盐,设计了以下两个实验方案:
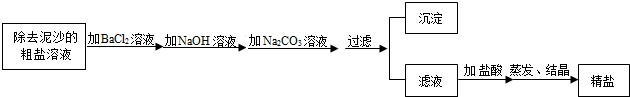
方案一:固体混合物
| 过量稀盐酸 |
| 蒸发 |
方案二:固体混合物
| 过量氯化钙 |
| 蒸发 |
你认为合理的实验方案是
方案一
方案一
.说明另一方案不合理的理由:
过量的氯化钙会带入新的杂质
过量的氯化钙会带入新的杂质
.分析:(1)根据纯碱与酸反应会生成二氧化碳气体,而氯化钠不具有此性质进行区分;
(2)根据纯碱能与酸反应,能与氯化钙反应进行实验方案设计,并从除杂的角度分析不能引入新的杂质进行评价.
(2)根据纯碱能与酸反应,能与氯化钙反应进行实验方案设计,并从除杂的角度分析不能引入新的杂质进行评价.
解答:解:(1)A、精盐(NaCl)和纯碱(Na2CO3)均溶于白酒,现象相同,故不能用白酒来区分;
B、米醋能够和碳酸钠反应产生二氧化碳,而和氯化钠不反应,因此各取少许精盐和纯碱于试管中,滴入2毫升醋酸,如果有气体产生,证明该物质是纯碱,而另一种物质是精盐,故可以鉴别;
C、精盐(NaCl)和纯碱(Na2CO3)均溶于纯净水,现象相同,故不能用纯净物来区分;
D、精盐(NaCl)和纯碱(Na2CO3)均溶于酱油,现象相同,故不能用酱油来区分.
故选B;
(2)碳酸钠能与盐酸反应生成氯化钠和水,也能与氯化钙反应生成碳酸钙和氯化钠,因此可加入盐酸或氯化钙溶液除去碳酸钠.
方案一固体混合物中加入过量盐酸溶液 过滤,蒸发滤液得到纯净的氯化钠固体;
方案二:固体混合物中加入过量的氯化钙溶液,过滤,蒸发滤液得到是氯化钠和氯化钙的混合固体;
因此合理的方案是方案一,因为方案二中加入过量的氯化钙后,滤液中会含有氯化钙,得到的精盐中会混有氯化钙.故此方案不合理.
故答案为:(1)B;(2)方案一,过量的氯化钙会带入新的杂质.
B、米醋能够和碳酸钠反应产生二氧化碳,而和氯化钠不反应,因此各取少许精盐和纯碱于试管中,滴入2毫升醋酸,如果有气体产生,证明该物质是纯碱,而另一种物质是精盐,故可以鉴别;
C、精盐(NaCl)和纯碱(Na2CO3)均溶于纯净水,现象相同,故不能用纯净物来区分;
D、精盐(NaCl)和纯碱(Na2CO3)均溶于酱油,现象相同,故不能用酱油来区分.
故选B;
(2)碳酸钠能与盐酸反应生成氯化钠和水,也能与氯化钙反应生成碳酸钙和氯化钠,因此可加入盐酸或氯化钙溶液除去碳酸钠.
方案一固体混合物中加入过量盐酸溶液 过滤,蒸发滤液得到纯净的氯化钠固体;
方案二:固体混合物中加入过量的氯化钙溶液,过滤,蒸发滤液得到是氯化钠和氯化钙的混合固体;
因此合理的方案是方案一,因为方案二中加入过量的氯化钙后,滤液中会含有氯化钙,得到的精盐中会混有氯化钙.故此方案不合理.
故答案为:(1)B;(2)方案一,过量的氯化钙会带入新的杂质.
点评:本题是对常见物质的鉴别和除杂的考查,根据物质的不同性质选择合适的试剂出现不同的现象进行鉴别,但在除杂时要注意除杂的原则:不能增加新的杂质,不能减少主题物质.

练习册系列答案
相关题目