题目内容
2.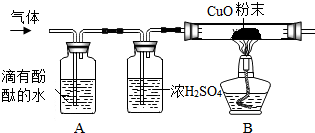 小明同学在实验室将镁放入NH4Cl溶液反应,发现有气泡产生.询问老师后得知镁与NH4Cl溶液反应能生成气体和一种盐.为了确定气体的成分,进行下列实验探究:
小明同学在实验室将镁放入NH4Cl溶液反应,发现有气泡产生.询问老师后得知镁与NH4Cl溶液反应能生成气体和一种盐.为了确定气体的成分,进行下列实验探究:【查阅资料】
①NH4Cl溶液显酸性:
②NH3+HCl═NH4Cl 2NH3+H2SO4═(NH4)SO4
③2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O
【探究实验】
(1)用湿润的蓝色石蕊试纸检验,试纸不变红色,则该气体中无HCl气体.
(2)为了探究其它气体是否存在,又设计了如图实验装置.
①A中溶液变红色,证明有NH3气体(填化学式);
②浓硫酸的作用是除去氨气.
③B中玻璃管内观察到黑色固体变成红色固体,玻璃管内壁出现水珠,说明有氢气.
【实验结论】镁与NH4Cl溶液反应生成NH3和H2.还生成一种盐的化学式是MgCl2.
【实验反思】
(1)综合以上信息和实验结论,小林同学认为不需要单独检验HCl气体,就能说明HCl气体不存在.请你评价这种说法是否合理并说明理由:合理,因为氨气能和氯化氢气体反应生成氯化铵,即氨气和氯化氢气体不能共存,既然气体中含有氨气,则一定不含有氯化氢气体.
(2)小敏同学为了更加充分证明反应生成的气体中有氢气,她在B装置的玻璃管后面再连接了装有无水硫酸铜的U型管,观察实验过程中U型管中的物质是否变蓝色.
分析 【探究实验】
氯化氢气体能和水结合成盐酸,盐酸显酸性,能使湿润的蓝色石蕊试纸变红色;
氨气能和水反应生成氨水,氨水显碱性,能使酚酞试液变红色;
浓硫酸能够吸收氨气;
加热条件下,氢气和氧化铜反应生成铜和水;
【实验结论】
镁和氯化铵溶液反应生成氯化镁、氨气和氢气;
【实验反思】
氯化氢气体能和氨气反应生成氯化铵,因此氨气和氯化氢气体不能共存;
无水硫酸铜能和水反应生成蓝色固体五水硫酸铜.
解答 解:【探究实验】
(1)用湿润的蓝色石蕊试纸检验,试纸不变红色,则该气体中无HCl气体.
故填:红.
(2)①A中溶液变红色,证明气体中含有NH3.
故填:NH3.
②浓硫酸的作用是除去氨气.
故填:除去氨气.
③B中玻璃管内观察到黑色固体变成红色固体,玻璃管内壁出现水珠,说明有氢气.
故填:黑色固体变成红色固体,玻璃管内壁出现水珠.
【实验结论】
镁与NH4Cl溶液反应生成NH3和H2.还生成一种盐氯化镁,氯化镁的化学式是MgCl2.
故填:MgCl2.
【实验反思】
(1)这种说法合理,这是因为氨气能和氯化氢气体反应生成氯化铵,即氨气和氯化氢气体不能共存,既然气体中含有氨气,则一定不含有氯化氢气体.
故填:合理,因为氨气能和氯化氢气体反应生成氯化铵,即氨气和氯化氢气体不能共存,既然气体中含有氨气,则一定不含有氯化氢气体.
(2)为了更加充分证明反应生成的气体中有氢气,可以在B装置的玻璃管后面再连接装有无水硫酸铜的U型管,实验过程中U型管中的无水硫酸铜如果变蓝色,说明反应生成了水,进一步说明气体中含有氢气,如果U型管中的无水硫酸铜不变蓝色,说明反应没有生成水,进一步说明气体中不含有氢气.
故填:无水硫酸铜.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 如图为某反应的微观示意图.下列说法正确的是( )
如图为某反应的微观示意图.下列说法正确的是( )| A. | 该反应的生成物中没有单质 | |
| B. | 该反应前后分子、原子的数目均不变 | |
| C. | 该反应属于置换反应 | |
| D. | 该反应中各物质的分子个数比为2:2:3 |
| A. |  向稀盐酸中加氯化铜,然后加入氢氧化钠溶液 | |
| B. |  向氢氧化钠溶液中加碳酸氢钠,然后加入稀盐酸溶液 | |
| C. |  向氢氧化钠溶液中加硝酸钡,然后加入稀硫酸溶液 | |
| D. |  向稀盐酸中加氯化钙,然后加入碳酸钠溶液 |
| A. | 该元素的原子核外有两个电子层 | B. | 该粒子带一个单位的负电荷 | ||
| C. | 该粒子核内有10个质子 | D. | 该粒子为Na+ |
| A. | 味精 | B. | 蔗糖 | C. | 花生油 | D. | 食盐 |
| A. | 它是混合物 | |
| B. | 它是一种不同于水的物质 | |
| C. | 它的分子之间有间隔 | |
| D. | 它的一个分子由 4 个氢原子和 2 个氧原子构成 |
| A. | 食用碘盐中的“碘”指碘原子 | |
| B. | 自然界中的水大多数是混合物 | |
| C. | 将煤块加工成粉末状是为了降低煤的着火点 | |
| D. | 向无色气体中伸入燃着的木条,木条熄灭,则该气体中一定不含氧气 |

 在学习“二氧化碳性质的探究”时,小刘同学将二氧化碳通入紫色石蕊试液中,发现变红了,是什么使紫色石蕊试液变红呢?他和小红同学进行如下探究:
在学习“二氧化碳性质的探究”时,小刘同学将二氧化碳通入紫色石蕊试液中,发现变红了,是什么使紫色石蕊试液变红呢?他和小红同学进行如下探究: