题目内容
7.如图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
(1)A中反应的化学方程式是Cu+2AgNO3=Cu(NO3)2+2Ag;
(2)C中反应现象是有气泡产生;
(3)要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是AB(填序号);
(4)D中反应的现象是有气泡产生,溶液由无色变成浅绿色.
分析 (1)根据铜和硝酸银反应生成硝酸铜和银进行分析;
(2)根据锌和稀盐酸反应生成氯化锌和氢气进行分析;
(3)根据金属活动性顺序进行分析;
(4)根据铁和稀硫酸反应生成硫酸亚铁和氢气进行分析.
解答 解:(1)铜和硝酸银反应生成硝酸铜和银,化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;
(2)锌和稀盐酸反应生成氯化锌和氢气,所以C中反应现象是有气泡产生;
(3)要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是AB,通过A说明铜比银活泼,通过B说明铁比铜活泼;
(4)铁和稀硫酸反应生成硫酸亚铁和氢气,所以D中反应的现象是有气泡产生,溶液由无色变成浅绿色.
故答案为:(1)Cu+2AgNO3=Cu(NO3)2+2Ag;
(2)有气泡产生;
(3)AB;
(4)有气泡产生,溶液由无色变成浅绿色.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
相关题目
17.下列有关物质燃烧现象的叙述中,正确的是( )
| A. | 铁丝在氧气中燃烧:火星四射,生成一种黑色固体 | |
| B. | 木炭在空气中燃烧:生成一种黑色固体 | |
| C. | 红磷在空气中燃烧:产生黄色火焰,生成大量的白色烟雾 | |
| D. | 硫粉在氧气中燃烧:产生淡蓝色火焰,生成一种刺激性气味的气体 |
15.下列物质间的每一转化不能都通过一步反应实现的是( )
| A. | Cu→CuO→Cu | B. | C→CO2→CO | C. | Fe→FeSO4→Fe | D. | HCl→MgCl2→HC1 |
2.现有甲、乙、丙、丁四种金属,将这四种金属粉末分别投入相同浓度的盐酸中,只有丙、丁发生反应并产生气泡,而且丁产生气泡比丙的更快;且乙不能和另外三种的盐溶液发生置换反应.这四种金属的活动性顺序是( )
| A. | 丁>丙>甲>乙 | B. | 乙>甲>丙>丁 | C. | 丙>丁>甲>乙 | D. | 丁>丙>乙>甲 |
12.锌和铁是人体必需的微量元素,锌元素和铁元素的根本区别是( )
| A. | 电子数不同 | B. | 相对原子质量不同 | ||
| C. | 质子数不同 | D. | 最外层电子数不同 |
16.日常生活中,下列现象属于化学变化的是( )
| A. | 给自行车打气 | B. | 荔枝腐烂 | C. | 蔗糖溶解 | D. | 玻璃破碎 |
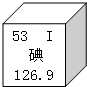 2011年3月11日13时45分,日本发生9级地震.
2011年3月11日13时45分,日本发生9级地震.