题目内容
1.林林同学从某化工厂取来100g含硫酸的废水,加入盛有10g黄铜粉(锌铜合金)杯中混合,至气泡不再产生为止,烧杯内的物质总质量变为109.8g.林林接着又取少量上述铜粉再加入烧杯中,又产生气泡.(1)产生的气体质量=0.2g;
(2)请列式计算这种黄铜的质量分数.
分析 根据黄铜的成分铜和锌的性质可知,只有锌与硫酸反应生成了硫酸锌和氢气;林林接着又取少量上述铜粉再加入烧杯中,又产生气泡,说明第一次实验后稀硫酸有剩余,100g含硫酸的废水是混合物,且硫酸有剩余,不能用100g进行计算;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量分数.
解答 解:(1)由质量守恒定律,生成氢气的质量为100g+10g-109.8g=0.2g.
(2)设参加反应的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{2}=\frac{x}{0.2g}$ x=6.5g
这种黄铜的质量分数为$\frac{10g-6.5g}{10g}×$100%=35%.
答:(1)0.2g;(2)这种黄铜的质量分数为35%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.检验一瓶长期暴露在空气中氢氧化钠是否变质,下列可作为检验试剂的是( )
| A. | 稀盐酸 | B. | 无色酚酞 | C. | 紫色石蕊试液 | D. | 水 |
12.下列各组物质的溶液,只需用稀硫酸就能鉴别出来的是( )
| A. | NaOH、NaCl、Na2CO3 | B. | Na2CO3、Ba(NO3)2、KOH | ||
| C. | Ba(OH)2、NaNO3、KCl | D. | K2CO3、Ba(NO3)2、BaCl2 |
9.甲同学做铁在氧气中燃烧实验时,先在集气瓶中放了少量水;乙同学做硫在氧气中燃烧实验时,仿照甲同学的操作,也在集气瓶中放少量水(其中溶有氢氧化钠),请简要说明上述两个实验放少量水作用是否相同,为什么?
6.X元素的相对原子质量为m,其原子最外层电子数为1;Y元素的相对原子质量为n,其原子最外层电子数为6.则其化合物中X,Y两元素的质量比为( )
| A. | m:2n | B. | 2m:n | C. | m:n | D. | m:3n |
18.在“2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑”的化学反应过程中,保持不变的粒子是( )
| A. | H2O | B. | H2 | C. | O2 | D. | H和O |
 化学语言包括文字语言、符号语言、图表语言等.
化学语言包括文字语言、符号语言、图表语言等.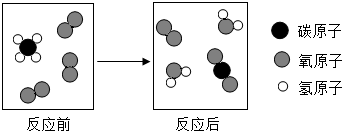
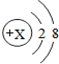 ,则X=11;
,则X=11;