题目内容
13.对比、分析、归纳是学习化学的重要方法.(1)已知H2、CO、C是初中化学常见的还原剂,请分析下列反应:
H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2
得出的结论是:物质(如H2、CO、C)作还原剂时,所含元素中,一定有元素的化合价在反应后升高(选填“升高”或“降低”或“不变”).
(2)依此,则在反应SO2+2H2S=3S+2H2O中作为还原剂的物质是H2S.
分析 根据题意,结合单质中元素的化合价为0、在化合物中正负化合价代数和为零,分析还原剂在化学反应前后元素化合价的变化,进行分析解答.
解答 解:(1)由H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O; Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2; C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,H2、C属于单质,氢元素和碳元素的化合价为0;CO中氧元素显-2价,碳元素显+2价;生成物水、二氧化碳中,水中氢元素显+1价,二氧化碳中碳元素显+4价,则物质(如H2、CO、C)作还原剂时,所含元素中,一定有元素的化合价在反应后升高.故填:升高;
(2)根据反应可以看出,二氧化硫中硫元素的化合价反应后降低,氧元素的化合价不变,故不是还原剂;硫化氢中氢元素的化合计反应前后不变,硫元素的化合价由反应前的-2价变为0价,故化合价升高,作的是还原剂;H2S;故填:H2S.
点评 本题难度不大,理解作还原剂的物质中反应后一定有元素的化合价在反应后升高是正确解答本题的关键.

练习册系列答案
相关题目
1.某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如下表所示.求:
(1)这瓶浓硫酸溶液的质量是多少克?溶质多少克?
(2)若将这瓶浓硫酸与500克水均匀混合,所得稀硫酸的质量分数是多少(结果保留到0.1%)
(3)欲配制1000克质量分数为19.6%的稀硫酸,需要这种浓硫酸多少毫升?水多少毫升?
| 浓硫酸(H2SO4)500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封储藏 | |
(2)若将这瓶浓硫酸与500克水均匀混合,所得稀硫酸的质量分数是多少(结果保留到0.1%)
(3)欲配制1000克质量分数为19.6%的稀硫酸,需要这种浓硫酸多少毫升?水多少毫升?
8.有一种石灰石样品,其中含有的杂质是二氧化硅.某学生想测定该样品的纯度,他取用2克这种石灰石样品,把20克稀盐酸分4次加入,充分反应后剩余固体的质量见下表.
问:
(1)2克石灰石样品中,有杂质多少克?
(2)石灰石样品的纯度是多少?
(3)100千克这种纯度的石灰石充分煅烧后,可得到固体多少千克?
| 稀盐酸的用量 | 第1次加入5克 | 第2次加入5克 | 第3次加入5克 | 第4次加入5克 |
| 剩余固体的质量 | 1.315克 | 0.63克 | 0.3克 | 0.3克 |
(1)2克石灰石样品中,有杂质多少克?
(2)石灰石样品的纯度是多少?
(3)100千克这种纯度的石灰石充分煅烧后,可得到固体多少千克?
18.下列有关氯化钠溶液配制的操作中,正确的是( )
| A. |  称量氯化钠 | B. |  量水的体积 | ||
| C. |  将水倒入烧杯 | D. |  溶解氯化钠时搅拌 |
5.下列化学方程式的书写及其所属基本反应类型均正确的是( )
| A. | 铜在空气中加热表面变黑:Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$ CuO化合反应 | |
| B. | 比较铜和银的活动性:Cu+2AgNO3═2Ag+Cu(NO3)2 置换反应 | |
| C. | 用石灰石与盐酸制取二氧化碳:CaCO3+2HCl═CaCl+H2O+CO2↑分解反应 | |
| D. | 用磁铁矿石(主要成分:Fe3O4)炼铁:4CO+Fe3O4 $\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 还原反应 |
5.下列说法正确的是( )
| A. | 使用催化剂可以生成更多的产物 | |
| B. | 因为水分子中含有氧原子,所以凉开水可以养鱼 | |
| C. | 稀有气体的化学性质不活泼,可作灯泡保护气 | |
| D. | 空气的污染物有可吸入颗粒物、二氧化硫、二氧化碳和二氧化氮等 |
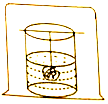 如图所示,在一个温度不变的密闭容器内,放入一杯饱和硫酸铜溶液,用细线吊住一块有缺口的硫酸铜晶体并浸在溶液中.过几天后观察到:晶体上的缺口没有(填“有”或“没有”)存在,晶体的质量不变(填“减小”、“增大”或“不变”).
如图所示,在一个温度不变的密闭容器内,放入一杯饱和硫酸铜溶液,用细线吊住一块有缺口的硫酸铜晶体并浸在溶液中.过几天后观察到:晶体上的缺口没有(填“有”或“没有”)存在,晶体的质量不变(填“减小”、“增大”或“不变”).