题目内容
5.氢氧化钠、氢氧化钙都是实验室常用的碱.(1)要鉴别氢氧化钠稀溶液和饱和氢氧化钙溶液,下列方法不能够达到目的是C(填序号).
A.分别滴加碳酸钠溶液B.分别通入二氧化碳C.分别滴加稀盐酸D.分别加热原溶液至80℃
(2)同学们将饱和氢氧化钙溶液与碳酸钠溶液混合,过滤得到滤渣和滤液.同时对滤液中溶质的成分进行了进一步探究:
【猜想与假设】甲同学认为:可能是NaOH、Na2CO3、Ca(OH)2;
乙同学认为:可能是NaOH、Na2CO3;
丙同学认为:可能是NaOH、Ca(OH)2;
丁同学认为:可能是NaOH(填化学式).
【交流与评价】经过讨论,大家一致认为甲同学的猜想不合理.理由是碳酸钠与氢氧化钙在溶液中不能共存.
【实验与探究】(1)乙同学取原滤液,向其中倾倒足量的稀盐酸,观察到有大量气泡产生,于是得出该滤液中溶质是NaOH、Na2CO3的结论,证实了自己的猜想.
(2)丙同学取原滤液向其中通入足量的CO2,溶液没有现象(填“有”或“没有”),据此否定了自己的猜想.
(3)丁同学为了验证乙同学结论也取原滤液向其中滴加了少量稀盐酸,却发现无气泡产生.
【解释与结论】大家经过分析找出了丁同学所用试剂与乙同学相同,却没有看到气泡的原因.你认为可能的原因是丁同学滴加的盐酸量过少,氢氧化钠的量较多与少量的盐酸反应.
分析 (1)根据氢氧化钠和氢氧化钙的性质的差异来解答,其中氢氧化钙和二氧化碳及碳酸钠反应都会生成沉淀,且氢氧化钙的溶解度随温度的降低而升高,可以据此解答该题;
(2)【猜想与假设】碳酸钠和氢氧化钙反应生成了氢氧化钠,所以在溶液中一定含有氢氧化钠,如果碳酸钠和氢氧化钙有一种量不足,则还可能含有碳酸钠或氢氧化钙,但不可能同时存在碳酸钠和氢氧化钙,可以据此作答;
【交流与评价】Na2CO3和Ca(OH)2在溶液中可以发生反应,所以不能在溶液中共存,可以据此解答;
【实验与探究】(2)丙同学猜想溶液中含有氢氧化钙,而氢氧化钙可以和二氧化碳反应生成沉淀,使溶液变浑浊,可以据此解答;
【解释与结论】如果盐酸的量不足,那么碳酸钠和盐酸反应的生成的二氧化碳马上就会和氢氧化钠反应,所以在有氢氧化钠存在的情况下,二氧化碳难以以气体的形式逸出,可以据此答题.
解答 解:(1)A、碳酸钠可以和氢氧化钙溶液反应生成白色沉淀,和氢氧化钠溶液不反应,所以可以用碳酸钠溶液来区分出氢氧化钠溶液和氢氧化钙溶液,故A能达到目的;
B、二氧化碳可以和氢氧化钙溶液反应生成白色沉淀,和氢氧化钠溶液反应时没有明显现象,所以可以用二氧化碳溶液来区分出氢氧化钠溶液和氢氧化钙溶液,故B能达到目的;
C、氢氧化钠溶液和氢氧化钙溶液都可以和稀盐酸反应,并且都没有明显的现象,故C不能达到目的;
D、氢氧化钙的溶解度随温度的升高而降低,所以加热后会由于溶解度降低而析出溶质,使溶液变浑浊,但是氢氧化钠的溶解度随温度的升高而增大,所以没有明显的现象,故D可达到目的.
故填:C.
(2)【猜想与假设】碳酸钠和氢氧化钙反应生成了氢氧化钠,所以在溶液中一定含有氢氧化钠,如果碳酸钠和氢氧化钙有一种量不足,则还可能含有碳酸钠或氢氧化钙,根据甲乙丙三位同学的猜想,如果碳酸钠溶液合氢氧化钙溶液恰好完全反应,则剩余的溶液中就只含有氢氧化钠一种溶质,故我们可以作出的假设为只含有氢氧化钠;故填:NaOH;
【交流与评价】Na2CO3和Ca(OH)2在溶液中可以发生反应,所以不能在溶液中共存,故可以判定甲的猜想是错误的;故填:甲;碳酸钠与氢氧化钙在溶液中不能共存;
【实验与探究】丙同学猜想溶液中含有氢氧化钙,而氢氧化钙可以和二氧化碳反应生成沉淀,而使溶液变浑浊,而丙同学通入二氧化碳后否定了自己的猜想,所以可以判定溶液没有变浑浊;故填:没有;
【解释与结论】在有氢氧化钠存在的情况下,碳酸钠和盐酸反应的生成的二氧化碳马上就会和氢氧化钠反应,所以在有氢氧化钠存在的情况下,二氧化碳难以以气体的形式逸出,所以为了能够观察到有气体产生,必须提供足量的稀盐酸,而本题中丁同学没有观察到气泡生成,可能是加入的盐酸的量不足造成的.故填:丁同学滴加的盐酸量过少,氢氧化钠的量较多与少量的盐酸反应.
点评 对反应后所得溶液的组成进行猜想时,首先可以确定反应后的生成物的存在,然后根据反应物的过量情况,对所得溶液进行猜想;碳酸钠能与盐酸反应,生成氯化钠和水和二氧化碳,常利用这一性质来检验氢氧化钠中是否含有碳酸钠.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 它们表示四种元素 | |
| B. | ③表示的元素在化合物中通常显+3价 | |
| C. | ①表示的元素是金属元素 | |
| D. | ②③④表示的是阳离子 |
| A. | 石蕊试液 | B. | 硝酸银溶液 | C. | 碳酸钠溶液 | D. | 硝酸钾溶液 |
[查阅资料]
(1)铜的氧化物主要有两种:CuO(黑色);Cu2O(红色)
(2)酒精在不完全燃烧使会产生炭黑
(3)炭黑不与稀硫酸反应,也不溶于稀硫酸;氧化铜可与稀硫酸反应而溶解
[提出假设]猜想1:黑色物质为氧化铜. 猜想2:黑色物质为炭黑
猜想3:黑色物质为氧化铜与炭黑的混合物
[设计方案]
| 操作步骤 | 实验中可能出现的现象 | 实验结论 |
| 取少量黑色固体于试管中,加入足量稀硫酸(填物质名称) | ①黑色固体消失,溶液变为蓝色 | 猜想1成立 |
| ②黑色固体没有减少,溶液颜色不变 | 猜想2成立 | |
| ③黑色固体部分消失,溶液变蓝 | 猜想3成立 |
①单质;②混合物;③化合物;④纯净物;⑤氧化物.
| A. | ①②③ | B. | ③④⑤ | C. | ①③⑤ | D. | ②③④⑤ |
 梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.
梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.【提出问题】锡纸的材质到底是锡还是铝呢?小吴认为可以把锡纸放入盐酸中观察是否有气体放出来区别是锡还是铝,小周同学认为这样不能区别,理由是锡和铝都能与盐酸反应生成氢气.小施查阅资料发现锡的熔点为232℃,而铝的熔点为660℃,他用加热的方法区别出锡纸的材质是铝不是锡,接着同学们对铝这种金属进行探究.
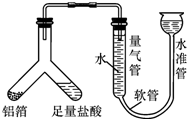
【探究活动一】铝的含量分析
(1)小施用如图装置测定铝箔中金属铝的含量,检查该装置气密性的操作是从水准管一端注入水,待水准管和量气管出现较大高度差为止,静止几分钟,两侧高度差不缩小,证明装置气密性好.
(2)若测定进入量气管的气体体积为100mL(氢气的密度为0.09g/L),铝箔中金属铝的质量为0.081g(铝箔中只有铝能与盐酸反应生成气体).
【探究活动二】铝箔燃烧
同学们做铝箔燃烧的实验.小吴用坩埚钳夹持一小块铝箔放在酒精灯火焰上,轻轻晃动,观察到铝箔熔化,失去了光泽,但铝箔并不燃烧;小周另取一块铝箔,用砂纸仔细打磨,再用坩埚钳夹持放在酒精灯的火焰上,观察到铝箔仍不能燃烧.
(1)小施同学认为铝箔不能在空气中燃烧是因为铝与氧气反应生成一层致密的氧化铝薄膜附在铝的表面,阻止反应的进行,这也是铝箔抗腐蚀性强的原因.
(2)小施同学改进了实验,让铝箔燃烧并发出耀眼的白光,小施同学的实验方案是将铝箔卷曲,尖端夹一根火柴,将火柴引燃后,把火柴和铝箔一起伸入到盛有氧气的集气瓶中即可观察到铝箔燃烧并发出耀眼的白光.
【探究活动三】小吴将打磨后的铝片与铜盐溶液反应,现象如下:
| 实验一:4mL8%CuSO4溶液 | 实验二:4mL8%CuCl2溶液 | |
| 实验 现象 | 短时间内无变化,一段时间后铝片上才出现少量红色的铜 | 铝片上迅速有红色的铜出现 |
(2)对比两个实验,小周推测对铝与铜盐溶液的反应可能有促进作用的离子是Cl-(填离子符号),为了验证此推测,小施向实验一的CuSO4溶液中加入1gNaCl(填化学式)固体,立即观察到铝片上出现大量红色的铜.
| A. | MFe2Ox是还原剂 | B. | SO2是该反应的催化剂 | ||
| C. | x<y | D. | SO2发生了分解反应 |

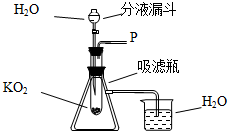 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动.