题目内容
17. 如图是需配制的硫酸钠溶液的标签,请计算(整个过程中可溶物完全溶解):
如图是需配制的硫酸钠溶液的标签,请计算(整个过程中可溶物完全溶解):(1)配制该硫酸钠溶液需要硫酸钠的质量为50g;
(2)烧杯中装有已配好的硫酸钠溶液142g,向其中加入某浓度的氯化钡溶液,恰好完全反应时,耗去氯化钡溶液115.3g,得到沉淀23.3g.求:
①该氯化钡溶液中溶质的质量.
②反应后所得滤液中溶质的质量分数.
分析 (1)根据溶质的质量=溶液质量×溶质的质量分数分析;
(2)根据硫酸钠的质量和化学方程式计算氯化钡和氯化钠的质量,进而计算所得滤液中溶质的质量分数.
解答 解:(1)溶液中溶质的质量为:500g×10%=50g;
(2)①设该氯化钡溶液中溶质的质量为x
BaCl2+Na2SO4=BaSO4↓+2NaCl
208 142 117
x 142g×10% y
$\frac{208}{x}$=$\frac{142}{142g×10%}$=$\frac{117}{y}$
解得:x=20.8g,y=11.7g
②反应后所得滤液中溶质的质量分数$\frac{11.7g}{142g+115.3g-23.3g}$×100%=5%
故答案为:(1)50(2)①20.8g②5%.
点评 溶液中溶质的质量分数=$\frac{溶质质量}{溶液质量}$×100%,这个公式要会灵活运用,知道其中的任意两个量,都能求出另外一个量.

练习册系列答案
相关题目
7.小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加.
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)硫酸亚铬(CrSO4)溶液呈蓝色.
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;分别进行了如下三个试管实验.
【结论与解释】
(1)小聪得到的三种金属活动性强弱顺序是Cr>Fe>Cu.
(2)实验前用砂纸打磨金属片的目的是除去金属表面的氧化膜(合理即可).
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
(2)硫酸亚铬(CrSO4)溶液呈蓝色.
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;分别进行了如下三个试管实验.
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 |  |  |  |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面先变灰黑后变银白,溶液由浅绿色逐渐变成为蓝色 | 无明显现象 |
(1)小聪得到的三种金属活动性强弱顺序是Cr>Fe>Cu.
(2)实验前用砂纸打磨金属片的目的是除去金属表面的氧化膜(合理即可).
9.下列除杂的实验过程都正确的( )
| A. | MnO2(KCl) 加水溶解、过滤、蒸发、结晶 | |
| B. | BaSO4(BaCO3) 加足量稀盐酸、过滤、洗涤、干燥 | |
| C. | CuO(Cu) 加足量稀盐酸、过滤、洗涤、干燥 | |
| D. | KCl(K2CO3) 加足量稀盐酸、过滤、洗涤、结晶 |
6.鉴别下列物质所使用的方法或试剂,错误的是( )
| A. | 氯化钾固体与氯化铵固体--用熟石灰 | |
| B. | 氧气与氮气--闻气味 | |
| C. | 铝与铝合金--比较硬度 | |
| D. | 氯化钠与碳酸钠--用稀盐酸 |
7.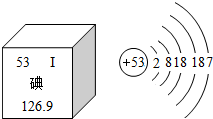 美国科学家罗伯特•莱夫科维茨和布莱恩•科比尔卡因进一步揭示了G蛋白偶联受体的内在工作机制,分享了当年的诺贝尔化学奖.莱夫科维茨从1968年便开始利用放射性碘来寻找细胞接受信号的物质,这种物质后来被称为“G蛋白偶联受体”.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )
美国科学家罗伯特•莱夫科维茨和布莱恩•科比尔卡因进一步揭示了G蛋白偶联受体的内在工作机制,分享了当年的诺贝尔化学奖.莱夫科维茨从1968年便开始利用放射性碘来寻找细胞接受信号的物质,这种物质后来被称为“G蛋白偶联受体”.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )
 美国科学家罗伯特•莱夫科维茨和布莱恩•科比尔卡因进一步揭示了G蛋白偶联受体的内在工作机制,分享了当年的诺贝尔化学奖.莱夫科维茨从1968年便开始利用放射性碘来寻找细胞接受信号的物质,这种物质后来被称为“G蛋白偶联受体”.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )
美国科学家罗伯特•莱夫科维茨和布莱恩•科比尔卡因进一步揭示了G蛋白偶联受体的内在工作机制,分享了当年的诺贝尔化学奖.莱夫科维茨从1968年便开始利用放射性碘来寻找细胞接受信号的物质,这种物质后来被称为“G蛋白偶联受体”.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )| A. | 碘的相对原子质量为126.9,原子核内质子数为53 | |
| B. | 碘原子核外共有53个电子,最外层有7个电子 | |
| C. | 碘元素属于非金属元素,碘原子在化学反应中容易得到电子 | |
| D. | 碘盐中含有碘酸钾(KIO3),KIO3中K、I、O的质量比为1:1:3 |

 松花蛋又名皮蛋,是老百姓喜爱的食品.某化学实验小组将制作皮蛋的原料:生石灰、纯碱和食盐放入足量水中,充分反应后过滤,得到澄清溶液和滤渣:(已知:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH)
松花蛋又名皮蛋,是老百姓喜爱的食品.某化学实验小组将制作皮蛋的原料:生石灰、纯碱和食盐放入足量水中,充分反应后过滤,得到澄清溶液和滤渣:(已知:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH)