题目内容
5.某化工厂排放的废水含有较多的 FeSO4,为综合利用 FeSO4,他们设计了以下工艺流程: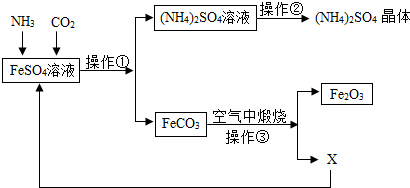
(1)生产过程中先向 FeSO4溶液中通入一定量氨气,再通入二氧化碳气体,这样做的目的是由于氨气溶解度比二氧化碳大,这样能吸收更多的二氧化碳
(2)操作①的名称是,其中用到的玻璃仪器有玻璃棒、烧杯和漏斗.
(3)操作③中X的化学式为:煅烧生成的Fe2O3可用于工业炼铁,该反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)该工艺流程中制取的(NH4)2SO4在农业上可以用作做氮肥.
分析 (1)根据碱性溶液能与酸性物质反应来分析;
(2)操作①是分离固体与液体的方法;
(3)根据质量守恒定律以及化学方程式的写法来分析;
(4)根据物质的组成来分析.
解答 解:(1)氨气极易溶于水,FeSO4溶液中通入一定量氨气,溶液显碱性,能吸收更多的二氧化碳气体;故填:由于氨气溶解度比二氧化碳大,这样能吸收更多的二氧化碳;
(2)操作①是用来分离沉淀和液体的方法,是过滤操作,过滤需要用到的玻璃仪器是漏斗、烧杯、玻璃棒;故填:过滤;漏斗;
(3)根据质量守恒定律可知,碳酸亚铁煅烧氧化铁和二氧化碳;在高温的条件下,一氧化碳与氧化铁反应生成铁和二氧化碳;故填:CO2;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)硫酸铵中含有氮元素,在农业上可以用作氮肥;故填:做氮肥.
点评 结合流程设计的目的制备硫酸铵,分析流程中所发生的反应,完成对流程的正确认识,此乃解答该问题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列说法正确的是( )
| A. | 常温下CO2是一种无色无味的有毒气体 | |
| B. | CO能溶于水生成酸 | |
| C. | CO2和CO都可以用来灭火 | |
| D. | 大气中CO2的消耗途径主要是植物的光合作用 |
10.侯德榜自创的“联合制碱法”生产的是( )
| A. | 碳酸钠 | B. | 硝酸钠 | C. | 氯化钠 | D. | 氢氧化钠 |
7.四种植物花汁在不同酸碱性下呈现的颜色如表所示.若要检测某溶液的酸碱性,最好选用( )
| pH | <7 | =7 | >7 |
| 玫瑰花汁 | 粉红 | 粉红 | 黄 |
| 万寿菊花汁 | 黄 | 黄 | 黄 |
| 大红花汁 | 橙 | 粉红 | 绿 |
| 万年青花汁 | 橙黄 | 浅绿 | 浅绿 |
| A. | 玫瑰花汁 | B. | 万寿菊花汁 | C. | 大红花汁 | D. | 万年青花汁 |
10. 学习碱的化学性质后,我们知道碱能与某些非金属氧化物反应.老师将二氧化碳通入氢氧化钠溶液中,但未看到明显现象,同学们分小组设计实验证明反应发生.下面是某一小组的交流过程:
学习碱的化学性质后,我们知道碱能与某些非金属氧化物反应.老师将二氧化碳通入氢氧化钠溶液中,但未看到明显现象,同学们分小组设计实验证明反应发生.下面是某一小组的交流过程:
[设计方案]
[交流讨论]
经讨论,同学们认为上述两个方案都不正确.
请选择上述一个方案,写出在实施过程中观察到的现象为气球鼓起来,该方案不能证明反应发生的理由是二氧化碳能与水反应或溶于水,也能使容器内气体减少,压强减小,气球鼓起来.
[进行实验]
随后,同学们进行了如下正确的实验:
[反思交流]
①请你再写出一个没有明显现象的化学方程式NaOH+HCl=NaCl+H2O.
②经过上述探究活动,同学们认为对于这类无明显现象的反应,想要证明其发生,我们设计实验的思路是:证明有新物质生成或证明反应物消失.
 学习碱的化学性质后,我们知道碱能与某些非金属氧化物反应.老师将二氧化碳通入氢氧化钠溶液中,但未看到明显现象,同学们分小组设计实验证明反应发生.下面是某一小组的交流过程:
学习碱的化学性质后,我们知道碱能与某些非金属氧化物反应.老师将二氧化碳通入氢氧化钠溶液中,但未看到明显现象,同学们分小组设计实验证明反应发生.下面是某一小组的交流过程:[设计方案]
[交流讨论]
经讨论,同学们认为上述两个方案都不正确.
请选择上述一个方案,写出在实施过程中观察到的现象为气球鼓起来,该方案不能证明反应发生的理由是二氧化碳能与水反应或溶于水,也能使容器内气体减少,压强减小,气球鼓起来.
[进行实验]
随后,同学们进行了如下正确的实验:
| 实验步骤 | 实验现象 | 结论 |
| 取NaOH溶液于试管中,向其中通入CO2,再向其中加入稀盐酸. | 有气泡生成 | 二氧化碳与氢氧化钠发生反应 |
①请你再写出一个没有明显现象的化学方程式NaOH+HCl=NaCl+H2O.
②经过上述探究活动,同学们认为对于这类无明显现象的反应,想要证明其发生,我们设计实验的思路是:证明有新物质生成或证明反应物消失.
17.下列化学方程式正确的是( )
| A. | 2Fe+3H2SO4═Fe2(SO4)3+H2↑ | B. | NaCl+KNO3═NaNO3+KCl | ||
| C. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | D. | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2↑+O2↑ |
15.在生活生产和化学实验中要特别注意安全.下列有关安全问题的叙述正确的是( )
| A. | 不小心打翻燃着的酒精灯失火,用干粉灭火器灭火 | |
| B. | 浓硫酸溅在手上,立即用大量水冲洗,再涂上3%-5%的氢氧化钠溶液 | |
| C. | 面粉加工厂、加油站、煤矿矿井、纺织厂都必须张贴“严禁烟火“字样 | |
| D. | 掏沼气池(沼气池内有大量可燃性气体CH4)前,先进行灯火试验 |
 我国大气污染的主要来源是生产和生活使用化石燃料、燃煤等,SO2是主要大气污染物之一,用石灰浆吸收SO2转化为石膏是一种工业上烟气脱硫的方法如图:
我国大气污染的主要来源是生产和生活使用化石燃料、燃煤等,SO2是主要大气污染物之一,用石灰浆吸收SO2转化为石膏是一种工业上烟气脱硫的方法如图: 为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组设计了如图所示的对照实验.
为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组设计了如图所示的对照实验.