题目内容
把249.5g稀盐酸加入盛有50g碳酸钙的烧杯中,恰好完全反应.试计算:
(1)所用稀盐酸的溶质的质量分数.(保留一位小数)
(2)反应后所得溶液中溶质的质量分数.
(1)所用稀盐酸的溶质的质量分数.(保留一位小数)
(2)反应后所得溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据碳酸钙的质量可以求算出稀盐酸中氯化氢的质量,然后结合溶质的质量分数计算公式进行计算即可;
(2)根据碳酸钙的质量结合反应的化学方程式可以计算出反应后生成的氯化钙的质量,然后计算溶质的质量分数.
(2)根据碳酸钙的质量结合反应的化学方程式可以计算出反应后生成的氯化钙的质量,然后计算溶质的质量分数.
解答:解:
设生成氯化钙的质量为x,盐酸中含有的氯化氢的质量为y,二氧化碳的质量为z
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
50g y x z
=
y=36.5g
=
x=55.5g
=
z=22g
(1)稀盐酸的质量分数为:
×100%=14.6%
(2)反应后所得溶液中溶质的质量分数为:
×100%=20%
答案:
(1)稀盐酸的质量分数为14.6%.
(2)反应后所得溶液中溶质的质量分数为20%.
设生成氯化钙的质量为x,盐酸中含有的氯化氢的质量为y,二氧化碳的质量为z
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
50g y x z
| 100 |
| 73 |
| 50g |
| y |
y=36.5g
| 100 |
| 111 |
| 50g |
| x |
x=55.5g
| 100 |
| 44 |
| 50g |
| z |
z=22g
(1)稀盐酸的质量分数为:
| 36.5g |
| 249.5g |
(2)反应后所得溶液中溶质的质量分数为:
| 55.5g |
| 249.5g+50g-22g |
答案:
(1)稀盐酸的质量分数为14.6%.
(2)反应后所得溶液中溶质的质量分数为20%.
点评:掌握化学方程式的计算格式和规范性,注意:反应后溶液的质量等于反应前各物质的质量和减去气体的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
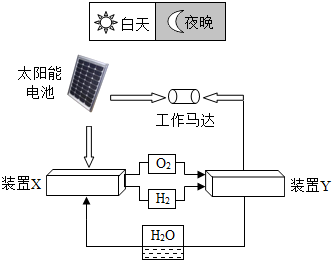 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )| A、太阳能电池板的原料是二氧化硅,硅的化合价是+2价 |
| B、装置X中的反应为2H2+O2═2H2O |
| C、装置Y中的反应为2H2+O2═2H2O |
D、氧元素的原子示意图: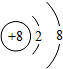 |
除去下列物质中混有的少量杂质(括号内是杂质),所用试剂及方法均正确的是( )
| A、铜粉(碳粉)-----在空气中燃烧 |
| B、生石灰(石灰石)----加水溶解、过滤 |
| C、二氧化碳(一氧化碳)----点燃 |
| D、氯化钠固体(碳酸钠固体)----滴加过量的稀盐酸,加热蒸发 |
下列对实验意外事故的处理错误的是( )
| A、碱液洒在衣服上,用水冲洗后,再涂上硫酸溶液 |
| B、实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓 |
| C、稀释浓硫酸时,应将浓硫酸慢慢的倒入水中 |
| D、浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上3%-5%的碳酸氢钠溶液 |