题目内容
石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验.
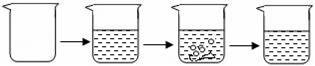
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 |
| |||
| 实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
【考点】含杂质物质的化学反应的有关计算;质量守恒定律及其应用.
【分析】(1)石灰石中主要成分碳酸钙可以与盐酸反应生成氯化钙、水和气体二氧化碳;随着反应的发生,二氧化碳不断放出而使烧杯内物质质量减小;完全反应前后烧杯中物质质量差为放出气体二氧化碳的质量;
(2)石灰石样品的纯度=
 ×100%,根据反应的化学方程式,可由反应放出二氧化碳的质量计算参加反应的碳酸钙的质量.
×100%,根据反应的化学方程式,可由反应放出二氧化碳的质量计算参加反应的碳酸钙的质量.
【解答】解:(1)根据质量守恒定律得:反应放出CO2的质量=﹣107.6g=4.4g;
(2)设12.0g石灰石样品中含CaCO3质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 4.4g
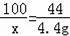

x=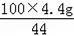
 =10.0g
=10.0g
该石灰石样品的纯度为: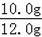
 ×100%=83.3%
×100%=83.3%
因83.3%<85%,所以该石灰石样品的纯度不符合要求.
答:(1)该实验中生成的二氧化碳的质量是4.4g;(2)该石灰石样品的纯度不符合要求.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目