题目内容
如图所示是铜粉和氧气反应生成氧化铜时,参与反应的铜粉质量与产物氧化铜的质量关系图,根据图分析氧化铜中铜和氧的质量比应约为
[
]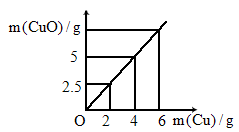
|
A .8 |
B .4 |
C .2 |
D .1 |
答案:B
解析:
解析:
|
解析:从图像上分析, 2g铜生成2.5g氧化铜,4g铜生成5g氧化铜,所以当铜的质量为2g时,氧的质量为2.5g-2g=0.5g;当铜的质量为4g时,氧的质量为5g-4g=1g,所以铜与氧的质量比为4∶1.点拨:该题是把数学图像知识与化学内容相结合的综合性习题,解题时认真分析图像中数据的变化规律,从中分析得出在氧化铜中铜、氧两种元素的质量比. |

练习册系列答案
相关题目
 某校课外活动小组模拟工业生产方法,用金属铜粉制取少量硫酸铜.请根据他们的实验操作,回答下面有关问题:
某校课外活动小组模拟工业生产方法,用金属铜粉制取少量硫酸铜.请根据他们的实验操作,回答下面有关问题:
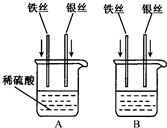 (2009?石景山区二模)回答下列问题.
(2009?石景山区二模)回答下列问题.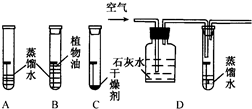
 汽车是现代生活中不可缺少的代步工具.请回答下列问题:
汽车是现代生活中不可缺少的代步工具.请回答下列问题: