题目内容
16. 运河水是我们共同的“血液”,水--20亿人生命所系.如图是市场上出售的一种活性炭净水器的示意图,这种净水器可以除去水中难溶性物质,a、b处为进水口的是( )
运河水是我们共同的“血液”,水--20亿人生命所系.如图是市场上出售的一种活性炭净水器的示意图,这种净水器可以除去水中难溶性物质,a、b处为进水口的是( )| A. | a处 | B. | b处 | C. | a、b处均可 | D. | 无法确定 |
分析 可以根据净化水的方法方面进行分析、考虑,活性炭有吸附性,能吸附水中的色素和异味.
解答 解:活性炭能吸附水中的色素和异味,水应该从b处进入,从a处流出,这样做的优点是难溶固体不会沉积在活性炭表面,同时除去臭味和不溶性物质的效果更好.
故填:B.
点评 解答本题的关键是要充分理解净化水的知识,根据净水的要求进行分析判断,解决实际问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.除去下列物质中的杂质(括号内为杂质),所选用试剂及操作方法均正确的是( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | CaCl2溶液 | 加适量CaCl2溶液,过滤、将滤液蒸发结晶 |
| B | Na2SO4(NaOH) | 稀盐酸 | 加过量稀盐酸、蒸发结晶 |
| C | KCl(KClO3) | MnO2 | 加MnO2,加热后冷却 |
| D | Fe2(SO4)3溶液(CuSO4) | 过量铁粉 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
4.工业上利用乙炔(C2H2)产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
生产流程为:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{置露于空气}{→}$残渣.
资料:电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:
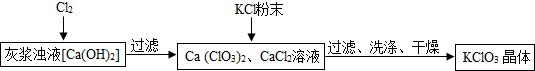
(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3晶体的原因是相同温度下,氯酸钾的溶解度小.
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐):
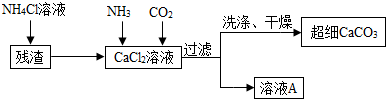
(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
生产流程为:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{置露于空气}{→}$残渣.
资料:电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaClO3 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐):

(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
11.如表所示实验操作中,不能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 鉴别纯棉制品和羊毛面料 | 分别取样灼烧、闻气味 |
| B | 提纯含少量泥沙的粗盐 | 将粗盐加适量水溶解、过滤、蒸发结晶 |
| C | 除去氯化钙溶液中少量盐酸 | 加入过量的碳酸钙粉末、充分反应后过滤 |
| D | 分离硫酸钠和硫酸锌的混合溶液 | 加入过量氢氧化钠溶液,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
1. 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )| A. | 红磷熄灭后应立刻打开弹簧夹 | |
| B. | 点燃红磷前先用弹簧夹夹紧橡皮管 | |
| C. | 最终瓶中剩余的气体主要是氮气 | |
| D. | 实验时,只取用极少量红磷,可减少污染且不影响实验结果 |
8.下列矿石的主要成分表达错误的是( )
| A. | 黄铁矿(FeS2) | B. | 菱铁矿(FeCO3) | C. | 黄铜矿(CuFeS2) | D. | 磁铁矿(FeS) |

