题目内容
将含有HCl、CO2、CO、N2、O2的混合气体依次作如下处理:①通过饱和的NaHCO3溶液;②通过足量的石灰水;③通过灼热的铜网;④通过灼热的CuO(假定各步参加反应气体均无剩余),最后剩下的气体物质有( )A.N2 和CO2 B.CO2
C.O2 D.CO
答案:A
提示:
提示:
| 饱和的NaHCO3溶液可吸收氯化氢气体,生成二氧化碳气体;石灰水可吸收二氧化碳气体;灼热的铜可与氧气反应生成氧化铜固体;灼热的氧化铜可与一氧化碳反应放出二氧化碳气体。
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
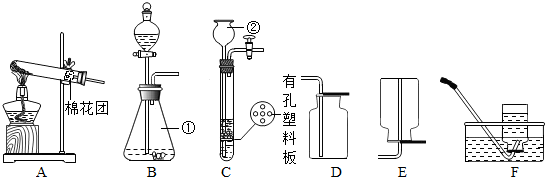
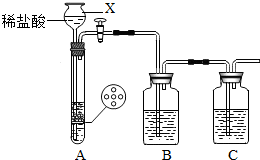 (2012?崇川区一模)某研究性学习小组设计并进行了如下实验.
(2012?崇川区一模)某研究性学习小组设计并进行了如下实验.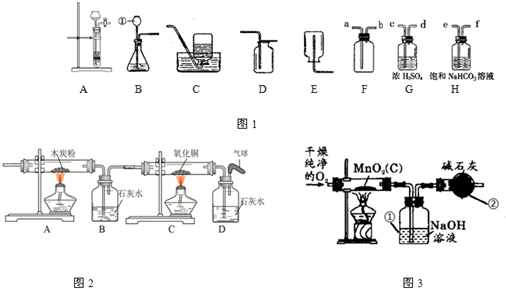
 碳酸氢钠(NaHCO3 )俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3 )俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.