题目内容
如图为某实验室盛放稀盐酸试剂瓶,为测定其质量分数,取6g溶液于试管中,向其中逐滴滴加10%的氢氧化钠溶液,用pH试纸不断测量溶液的酸碱度,当滴加至4g时,溶液pH值恰好为7.
(1)用pH试纸测定溶液的酸碱度的具体方法是 .
(2)试计算:
①稀盐酸的质量分数.
②试管中所得溶液的质量分数.(测定溶液的酸碱度造成的溶液质量损失忽略不计,计算结果精确至1%)
(1)用玻璃棒蘸取溶液滴到pH试纸上,然后将显示的颜色与标准比色卡比较得到溶液的pH值
(2)①6% ②6%
【解析】
试题分析:(1)根据测定溶液酸碱度的方法进行解答;
(2)依据盐酸和氢氧化钠溶液恰好反应时溶液的pH值为7,此时反应的氢氧化钠溶液的质量是4g,据此计算氢氧化钠的质量,依据方程式计算盐酸、氯化钠的质量,并计算溶液溶质的质量分数.
解:(1)用pH试纸测定溶液的酸碱度的具体方法是:用玻璃棒蘸取溶液滴到pH试纸上,然后将显示的颜色与标准比色卡比较得到溶液的pH值;
故答案为:用玻璃棒蘸取溶液滴到pH试纸上,然后将显示的颜色与标准比色卡比较得到溶液的pH值;
(2)盐酸和氢氧化钠溶液恰好反应时氢氧化钠的质量是:4g×10%=0.4g
设所取稀盐酸中溶质的质量是x,生成氯化钠的质量是y
HCl+NaOH═NaCl+H2O
36.5 40 58.5
x 0.4g y
 =
=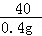
x=0.365g
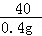 =
=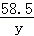
y=0.585g
∴该盐酸溶质质量分数为: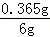 ×100%≈6%;
×100%≈6%;
试管中所得溶液的质量分数为: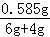 ×100%≈6%
×100%≈6%
答:稀盐酸的质量分数约是6%,试管中所得溶液的质量分数约是6%.
考点:根据化学反应方程式的计算;溶液的酸碱度测定;有关溶质质量分数的简单计算.
点评:酸和碱恰好反应时溶液的pH值恰好为7,据此结合题目所给数据及方程式进行解答.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 如图为某实验室盛放稀盐酸试剂瓶,为测定其质量分数,取6g溶液于试管中,向其中逐滴滴加10%的氢氧化钠溶液,用pH试纸不断测量溶液的酸碱度,当滴加至4g时,溶液pH值恰好为7.
如图为某实验室盛放稀盐酸试剂瓶,为测定其质量分数,取6g溶液于试管中,向其中逐滴滴加10%的氢氧化钠溶液,用pH试纸不断测量溶液的酸碱度,当滴加至4g时,溶液pH值恰好为7. 如图为某实验室盛放稀盐酸试剂瓶,为测定其质量分数,取6g溶液于试管中,向其中逐滴滴加10%的氢氧化钠溶液,用pH试纸不断测量溶液的酸碱度,当滴加至4g时,溶液pH值恰好为7.
如图为某实验室盛放稀盐酸试剂瓶,为测定其质量分数,取6g溶液于试管中,向其中逐滴滴加10%的氢氧化钠溶液,用pH试纸不断测量溶液的酸碱度,当滴加至4g时,溶液pH值恰好为7.