题目内容
1.甲同学查阅资料知道了CuO粉末也能作为H2O2分解的催化剂,于是他依次设计了三个实验来验证.实验一:取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃.说明H2O2溶液常温下缓慢分解;
实验二:在实验一的试管中加入2gCuO粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃.说明CuO能在常温下使H2O2溶液快速分解产生氧气;
实雎三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称S量,固体质量仍为2g.说明CuO在化学反应前后质量没有改变;
【实验结论】甲同学认为,CuO粉末可以作为H2O2分解的催化剂.
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验.探究CuO的化学性质在化学反应前后是否发生改变.
分析 根据催化剂的概念可知,催化剂能改变化学反应的速率,而本身的质量和化学性质在反应前后不改变进行分析.
解答 解:实验二:在实验一的试管中加人2gCuO粉末,有大气泡产生,然后伸入带火星的木条,木条复燃.说明溶液中加入氧化铜粉末,分解速率加快;
实验三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体的质量仍为2g.说明反应前后物质的质量不变;
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验,探究氧化铜粉末的化学性质是否改变.
故答案为:实验二:CuO能在常温下使H2O2溶液快速分解产生氧气;
实验三:CuO在化学反应前后质量没有改变;
【反思评价】CuO的化学性质在化学反应前后是否发生改变;
点评 本题主要考查了催化剂的催化作用及其正确设计实验方案等方面的内容,可以依据题干提供的信息结合已有的知识进行.

练习册系列答案
相关题目
1.一定温度下,一定质量的氢氧化钠固体溶于水制成溶液.下列有关的量不随水的质量改变而改变的是( )
| A. | 溶质质量分数 | B. | 最多能吸收二氧化碳的质量 | ||
| C. | 溶液的pH | D. | 氢氧化钠的溶解度 |
12.下列说法中不正确的是( )
| A. | 炼钢、气焊和宇宙航行等都要用到氧气 | |
| B. | 氦可用于制造低温环境 | |
| C. | 氧气支持燃烧,具有可燃性 | |
| D. | 氮气用于磁悬浮列车 |
16.葡萄糖(化学式为C6H12O6)可用于医疗,关于葡萄糖的描述正确的是( )
①该物质是由碳、氢、氧三种原子构成
②该物质是由碳、氢、氧三种元素组成的
③它的分子是由六个碳元素、11二个氢元素和六个氧元素构成的
④该物质是由葡萄糖分子构成的.
①该物质是由碳、氢、氧三种原子构成
②该物质是由碳、氢、氧三种元素组成的
③它的分子是由六个碳元素、11二个氢元素和六个氧元素构成的
④该物质是由葡萄糖分子构成的.
| A. | ② | B. | ②④ | C. | ①③ | D. | ②③ |
13.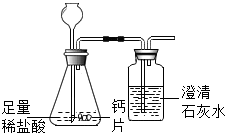 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据下图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止CO2气体逸出.
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好.
(4)记录数据如下:
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量.记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
【分析和评价】
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.
 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据下图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止CO2气体逸出.
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好.
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.

