题目内容
13.某种无色液体A和某种黑色粉末B混合后加热,生成无色液体C和无色气体D;另取一种黑色固体E,点燃后放入D中,发出白光,放出大量的热,只生成无色能使澄清石灰水变浑浊的气体F(1)请分别写出A、C、D、F的化学式:
AH2O2、CH2O、DO2、FCO2;
(2)黑色物质B在反应中起催化作用,写出该反应的方程式2H2O2MnO2?2H2O+O2↑;
(3)写出E和D反应生成F的方程式C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
分析 根据取一种黑色固体E,点燃后放入D中,发出白光,放出大量的热,只生成无色能使澄清石灰水变浑浊的气体F,所以F是二氧化碳,D具有助燃性,D是氧气,所以E是碳,无色液体A和某种黑色粉末B混合后加热,生成无色液体C和氧气,所以A是过氧化氢溶液,B是二氧化锰,C是水,然后将推出的物质进行验证即可.
解答 解:(1)取一种黑色固体E,点燃后放入D中,发出白光,放出大量的热,只生成无色能使澄清石灰水变浑浊的气体F,所以F是二氧化碳,D具有助燃性,D是氧气,所以E是碳,无色液体A和某种黑色粉末B混合后加热,生成无色液体C和氧气,所以A是过氧化氢溶液,B是二氧化锰,C是水,经过验证,推导正确,所以A是H2O2,C是H2O,D是O2,F是CO2;
(2)通过推导可知,黑色物质B在反应中起催化作用,过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)E和D反应生成F的反应是碳和氧气在点燃的条件下生成二氧化碳,化学方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
故答案为:(1)H2O2,H2O,O2,CO2;
(2)催化,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.一氧化碳中混有少量二氧化碳,除去二氧化碳的方法是( )
| A. | 将气体通过灼热的氧化铜 | B. | 将气体通入足量的澄清石灰水中 | ||
| C. | 将气体点燃 | D. | 倾倒,将上层的二氧化碳倒出 |
1. 如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
 如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )| A. | 甲物质的溶解度为60g | |
| B. | 阴影部分各点对应的溶液(不包括曲线上的点)是甲的不饱和溶液,乙的饱和溶液 | |
| C. | 升高温度可使不饱和的甲溶液变为饱和 | |
| D. | 45℃时,两物质各10克分别加水至恰好溶解,所得饱和溶液质量是甲小于乙 |
8.学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂.请你一起参与他们的探究过程,并填写下列空白.
【提出问题】Al2O3能不能作过氧化氢分解的催化剂呢?
【作出猜想】Al2O3能作过氧化氢分解的催化剂.
【实验验证】
【得出结论】Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂.
【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验三:
实验三:
【实验目的】探究Al2O3在反应前后质量是否改变.
【实验步骤】①准确称量Al2O3(少量)的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量;
④对比反应前后Al2O3的质量.
【交流讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂.
【提出新的问题】但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验四:
实验四的目的是探究Al2O3的化学性质在反应前后是否改变.
【提出问题】Al2O3能不能作过氧化氢分解的催化剂呢?
【作出猜想】Al2O3能作过氧化氢分解的催化剂.
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. | |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 |
【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验三:
实验三:
【实验目的】探究Al2O3在反应前后质量是否改变.
【实验步骤】①准确称量Al2O3(少量)的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤,干燥,称量;
④对比反应前后Al2O3的质量.
【交流讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂.
【提出新的问题】但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验四:
实验四的目的是探究Al2O3的化学性质在反应前后是否改变.
2.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊 的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色;结论是CO2+H2O=H2CO3 (用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
(3)实验三目的是探究对硝酸钾溶解性的影响;
实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和溶剂的量.
【活动与探究三】定量测定空气中氧气的含量.
(4)实验五中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);
装置一比装置二更合理,理由是装置一中氧气反应的更充分.
根据下表提供的实验数据,完成下表:
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小(填“偏小、‘偏大”或“无影响”).
【活动与探究一】用对比实验方法探究二氧化碳的性质.
| 实验一 | 实验二 |
 | 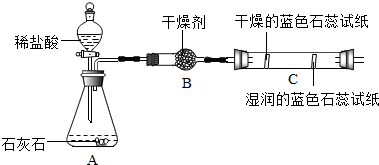 |
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色;结论是CO2+H2O=H2CO3 (用化学方程式表示).
| 实验三 | 实验四 |
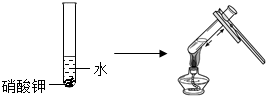 |  |
(3)实验三目的是探究对硝酸钾溶解性的影响;
实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和溶剂的量.
【活动与探究三】定量测定空气中氧气的含量.
| 实验五 | |
 |  |
装置一比装置二更合理,理由是装置一中氧气反应的更充分.
根据下表提供的实验数据,完成下表:
| 硬质玻璃管的容积 | 反应前注射器中气体体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL |
3.为了发展低碳经济,最近有科学家提出“绿色自由”构想:把空气吹入饱和碳酸钾溶液中生成KHCO3,然后利用KHCO3受热易分解产生CO2的性质,把CO2从溶液中提取出来,再经化学反应使之变为可再生燃料甲醇(CH4O).“绿色自由”构想的技术流程如下,则下列有关说法中,错误的是( )


| A. | 吸收池发生的主要反应为CO2+K2CO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2KHCO3 | |
| B. | 分解池发生的主要反应为2KHCO3═K2CO3+CO2↑+H2O | |
| C. | 由分解池分解后所得溶液X可通入吸收池再利用,其主要成分是K2CO3 | |
| D. | 合成塔中发生反应的化学方程式为2H2+CO2$\frac{\underline{\;\;\;\;\;\;\;\;\;铬锌触媒\;\;\;\;\;\;\;\;\;}}{300℃、2×105Pa}$CH4O(甲醇) |

 根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
根据如图中a、b、c三种物质的溶解度曲线,回答下列问题: