题目内容
2.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:【活动与探究一】用对比实验方法探究二氧化碳的性质.
| 实验一 | 实验二 |
 | 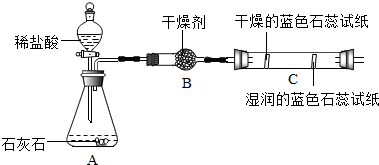 |
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色;结论是CO2+H2O=H2CO3 (用化学方程式表示).
| 实验三 | 实验四 |
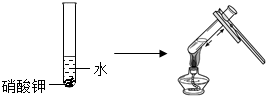 |  |
(3)实验三目的是探究对硝酸钾溶解性的影响;
实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和溶剂的量.
【活动与探究三】定量测定空气中氧气的含量.
| 实验五 | |
 |  |
装置一比装置二更合理,理由是装置一中氧气反应的更充分.
根据下表提供的实验数据,完成下表:
| 硬质玻璃管的容积 | 反应前注射器中气体体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL |
分析 二氧化碳的化学性质有:既不能燃烧也不能支持燃烧,也不供给呼吸;能与水反应生成碳酸;能使澄清的石灰水变浑浊.用对比实验方法探究二氧化碳的性质:
实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生的反应是:二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,对比A瓶与C瓶的实验现象,可证明CO2能与NaOH发生反应;
实验二观察到C装置中发生的现象是:干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色;因为二氧化碳与水反应生成了碳酸;
实验五中,反应的原理为铜和氧气在加热的条件下生成氧化铜,装置一比装置二更合理,理由是装置一中氧气反应的更充分;实验测得空气中氧气的体积分数=$\frac{8mL}{50mL}×100%$≈16%;定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小,因为冷却以后,注射器推进的少了.
解答 解:(1)用对比实验方法探究二氧化碳的性质:实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生的反应是:二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,对比A瓶与C瓶的实验现象,可证明CO2能与NaOH发生反应;故答案为:Ca(OH)2+CO2=CaCO3↓+H2O;C;
(2)实验二观察到C装置中发生的现象是:干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色;因为二氧化碳与水反应生成了碳酸;故答案为:干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色;CO2+H2O=H2CO3;
(4)实验五中,反应的原理为铜和氧气在加热的条件下生成氧化铜,装置一比装置二更合理,理由是装置一中氧气反应的更充分;实验测得空气中氧气的体积分数=$\frac{8mL}{50mL}×100%$≈16%;定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小,因为冷却以后,注射器推进的少了.
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;装置一中氧气反应的更充分;16%;偏小.
点评 本考点考查了二氧化碳的性质、空气组成的测定、影响物质溶解性的因素等,学生体验了科学探究的过程,二氧化碳与人类生活密切相关,在自然界中实现了碳循环.要加强记忆有关的知识点,并理解应用.本考点主要出现在填空题题和实验题中.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案| A. | 将带火星的木条伸入集气瓶中 | B. | 将带火星的木条放到集气瓶口 | ||
| C. | 将燃着的木条伸入集气瓶中 | D. | 将澄清的石灰水倒入集气瓶中 |
| A. | 青蒿素是有机物 | B. | 青蒿素由C、H、O三个元素组成 | ||
| C. | 青蒿素中氢元素的质量分数最小 | D. | 青蒿素是由分子构成的物质 |




 2012年1月15日,广西龙江河发生隔污染事件,一度造成柳江上游非饮用水保护河段轻微污染.为防止水源进一步被污染,当地政府迅速组织人员向江水里投放石灰提高受污染水的pH值,使水呈弱碱性,此时隔离子将以碳酸镉,氢氧化镉细小颗粒沉淀,同时投放聚合氯化铝将这些细小颗粒凝聚,以降低镉污染.
2012年1月15日,广西龙江河发生隔污染事件,一度造成柳江上游非饮用水保护河段轻微污染.为防止水源进一步被污染,当地政府迅速组织人员向江水里投放石灰提高受污染水的pH值,使水呈弱碱性,此时隔离子将以碳酸镉,氢氧化镉细小颗粒沉淀,同时投放聚合氯化铝将这些细小颗粒凝聚,以降低镉污染.