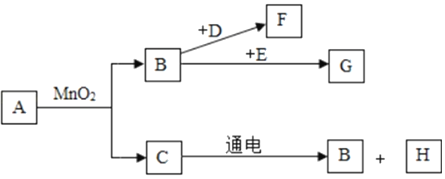
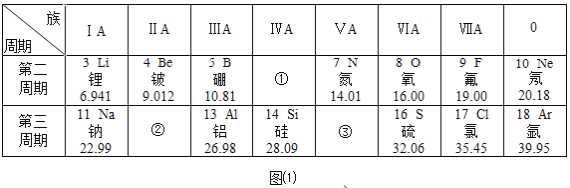
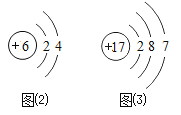
题目内容
【题目】甲、乙两种不含结晶水的固体物质的溶解度曲线如下图,下列说法中正确的是
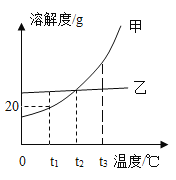
A.t1℃时,将12g甲加入50g水中充分溶解后得到溶液质量是62g
B.t2℃时,甲、乙饱和溶液降温到t1℃,所得溶液中乙溶液的溶质质量分数大于甲
C.t3℃时,甲的不饱和溶液可通过加溶质或蒸发水或升高温度让它达到饱和
D.甲中含有少量乙时,可用蒸发结晶的方法提纯甲
【答案】B
【解析】
A、 t1℃时,甲的溶解度为20g,根据溶解度概念可知,t1℃时,100水中最多溶解20g的甲,50g水中最多溶解10g甲,将12g甲加入50g水中充分溶解后得到溶液质量=50g+10g=60g,故A错误;
B、 将t2℃时甲、乙两种物质的饱和溶液降温到t1℃时,甲、乙的溶解度减小,甲、乙有晶体析出,质量分数变小,溶液仍为饱和溶液,一定温度下饱和溶液的溶质分数=![]() ,溶解度越大,质量分数越大,t1℃时乙的溶解度大于甲的溶解度,所以t1℃时甲、乙两物质的溶质质量分数由大到小的顺序是乙>甲,故B正确;
,溶解度越大,质量分数越大,t1℃时乙的溶解度大于甲的溶解度,所以t1℃时甲、乙两物质的溶质质量分数由大到小的顺序是乙>甲,故B正确;
C、甲溶解度随温度的降低而降低,t3℃时,甲的不饱和溶液可通过加溶质或蒸发水或降低温度让它达到饱和,故C错误;
D、甲、乙溶解度随温度的降低而降低,甲的溶解度受温度影响较大,甲中含有少量的乙时,可用降温结晶的方法提纯甲,故D错误。故选B。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】空气中氧气含量测定的再认识。
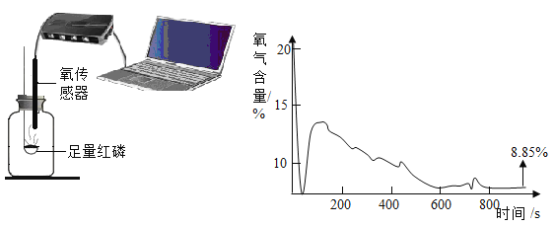
(一)某化学实验小组点燃红磷,并用氧传感器测定空气中的氧气含量并采集数据如上图。
(1)红磷在瓶中燃烧产生的现象是_____,红磷燃烧的化学方程式是_____。
(2)开始时氧气的含量持续下降,一方面是氧气被消耗,另一方面是生成物大量和氧传感器接触,但在110s时氧气的含量又有所上升,其可能原因是_____。
(3)从以上数据分析最终集气瓶中的氧气是否完全消耗_____。
(二)针对以上实验测定结果实验小组同学对该实验做了以下两种改进:

Ⅰ.根据铁在空气中生锈的原理设计如图实验装置,测定空气中氧气含量。
查资料:装置中饱和食盐水、活性炭会加速铁生锈。
测得实验数据如下表:
测量项目 | 实 验 前 | 实 验 后(冷却到室温后) | ||
烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)的容积 | 导管的容积 | |
体积/mL | 80.0 | 54.5 | 126.0 | 6.0 |
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式_____;该反应的基本类型是_____。
(2)根据上表数据计算,改进实验后测得的空气中氧气的体积分数是_____%(结果精确到0.1%)。
(3)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是:
①_____;②_____。
Ⅱ.将足量白磷放在集气瓶中,白磷能发生缓慢氧化从而消耗氧气,并用压强传感器测定瓶中压强的变化,根据压强的变化来计算空气中氧气的含量,实验装置及数据采集如下图。
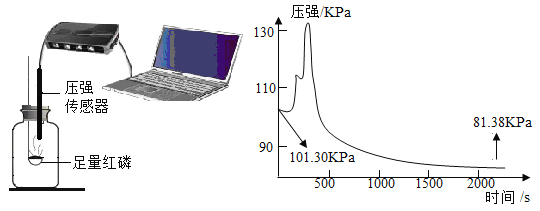
(1)在开始200s压强增大,增大的原因是_____。
(2)用上图所示数据计算用这种方法测得的空气中氧气的体积分数是_____%(结果精确到0.1%)。
(三)结论:测定空气中氧气含量用燃烧法测定结果误差较大,用缓慢氧化误差较小。