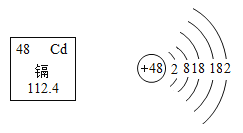题目内容
【题目】如图是元素周期表的一部分,请观察周期表,然后回答下列问题。
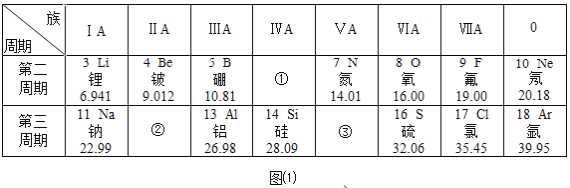
(1)在图1中,原子序数为15的元素名称为_____________,其单质在空气中燃烧的反应化学符号表达式为__________________,第三周期从第11号元素至第17号元素中,金属性最强的元素是_____________(填写元素符号,下同),地壳中含量最多的金属元素是_______________。
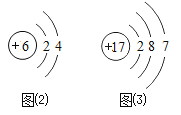
(2)图2是碳元素的原子结构示意图,该元素在图1中的位置是__________(填“①、②”或“③”)
(3)图3是氯元素的原子结构示意图,图1中与氯元素在同一列的氟元素,其原子结构与氯原子相似。由此推测,氟原子在化学反应中易______________(填“得”或“失”)电子,形成___________离子(填“阳”或“阴”)。
(4)写出原子序数为11、16的两种元素所组成的化合物的化学式___________。
【答案】磷 P+O2![]() P2O5 Na Al ① 得 阴 Na2S
P2O5 Na Al ① 得 阴 Na2S
【解析】
磷在氧气中点燃生成五氧化二磷,地壳中含量最多的金属元素是铝元素。
(1)在图1中,原子序数为15的元素名称为磷元素,其单质在空气中燃烧生成五氧化二磷,反应化学符号表达式为P+O2![]() P2O5,第三周期从第11号元素至第17号元素中,金属性逐渐减弱,故金属性最强的元素是钠元素,元素符号为Na,地壳中含量最多的金属元素是铝元素,元素符号为Al。
P2O5,第三周期从第11号元素至第17号元素中,金属性逐渐减弱,故金属性最强的元素是钠元素,元素符号为Na,地壳中含量最多的金属元素是铝元素,元素符号为Al。
(2)图2是碳元素的原子结构示意图,碳原子质子数是6,故该元素在图1中的位置是①。
(3)图3是氯元素的原子结构示意图,图1中与氯元素在同一列的氟元素,其原子结构与氯原子相似。最外层电子数为7,大于4,由此推测,氟原子在化学反应中易得电子,形阴离子。
(4)原子序数为11的元素是钠元素,16的元素是硫元素,两种元素所组成的化合物是硫化钠,化学式为Na2S。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案