题目内容
13.根据如图所示的实验回答下列问题: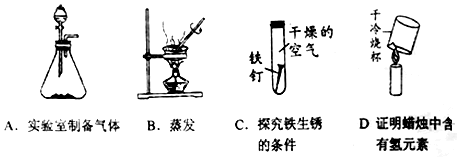
(1)实验A中制备氧气的原理2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑(用化学方程式表示).
(2)实验B中玻璃棒的作用是搅拌,使液体受热均匀,防止局部受热过高造成液滴飞溅,当蒸发皿中出现较多量晶体时停止加热.
(3)实验C中铁钉表面无明显现象,不能(填“能”或“不能”)说明铁生锈的条件是氧气和水.
(4)实验D中证明蜡烛中含有氢元素的理论依据是化学反应前后元素的种类不变.
分析 (1)根据制备气体的装置来确定制取原理;
(2)根据蒸发结晶的实验操作以及注意事项来分析;
(3)根据该实验需要对比空气、水对铁生锈的影响,进行分析判断;
(4)根据质量守恒定律来分析解答.
解答 解:(1)装置A适用于固液常温下制取气体,即过氧化氢在二氧化锰的催化作用下分解为水和氧气;故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)在蒸发结晶的过程中要用玻璃棒不断地搅拌,此目的是使液体受热均匀,防止局部受热过高造成液滴飞溅;当蒸发皿中出现较多量晶体时,即停止加热;故填:搅拌,使液体受热均匀,防止局部受热过高造成液滴飞溅;较多量晶体;
(3)该实验需要对比空气、水对铁生锈的影响,不能说明铁生锈的条件是要有氧气和水,故填:不能;
(4)将一干而冷的烧杯罩在蜡烛火焰的上方,烧杯内壁出现水雾,说明有水生成,由质量守恒定律可知,反应前后元素的种类不变,这说明了蜡烛中含有氢元素;故填:化学反应前后元素的种类不变.
点评 本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,难度适中.

练习册系列答案
相关题目
1.下列关于“化学之最”的说法中不正确的是( )
| A. | 相同条件下,密度最小的气体是氢气 | |
| B. | 最小的粒子是原子 | |
| C. | 天然存在最硬的物质是金刚石 | |
| D. | 人体中含量最多的物质是水 |
18.小明设计了下列四组物成,要求在一定条件下都能一步转化,其中错误的是( )
| A. | Na2CO3→NaCl→NaNO3→NaOH | B. | C→CO→Fe→Fe2O3 | ||
| C. | Cu→CuO→CuSO4→Cu(OH)2 | D. | CaCO3→CaO→Ca(OH)2→NaOH |
5.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 验证氯化钠溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
| B | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
| C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
| D | 除去粗盐中的可溶性杂质 | 将粗盐研碎,溶解,蒸发 |
| A. | A | B. | B | C. | C | D. | D |
2.现有含氯化钠的碳酸钠样品,为测定样品中氯化钠的含量.课外活动小组的同学称取20g该样品于烧杯中,并将80g稀盐酸评价分成四份,依次加入烧杯中,实验数据如表:
计算:
(1)产生CO2气体的总质量;
(2)样品中氯化钠的百分含量;
(3)使用的稀盐酸的溶质质量分数.
| 实验序号 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
| 反应后烧杯中剩余物质的质量/g | 37.8 | 55.6 | 74.5 | 94.5 |
(1)产生CO2气体的总质量;
(2)样品中氯化钠的百分含量;
(3)使用的稀盐酸的溶质质量分数.


