题目内容
20. 实验室中用如下实验来研究铁、铝、铜三种金属活动顺序及其在活动顺序表中相对氢的位置.
实验室中用如下实验来研究铁、铝、铜三种金属活动顺序及其在活动顺序表中相对氢的位置.①乙实验的现象为铁表面附着红色固体,溶液由蓝色变为浅绿色.
②若将上述实验之一替换掉一种药品,即可达成实验目的.说明具体的改进方法:将乙实验中的硫酸铜溶液换为稀硫酸.
③按如图实验结束后,将乙、丙实验后的剩余物倾倒至一个烧杯中,充分反应.然后将甲实验的剩余物倒入此烧杯,无气泡产生.以下说法正确的是A、B(填字母序号).
A.最后烧杯中的溶液不可能是无色的
B.乙实验中,CuSO4溶液一定是过量的
C.乙、丙混合过程中,可能没有发生化学反应
D.最后烧杯中的溶液,一定含有Al2(SO4)3,可能含有FeSO4.
分析 ①根据铁能与硫酸铜反应解答;
②根据验证金属活动性顺序的反应选择药品;
③将甲实验的剩余物倒入此烧杯,无气泡产生,说明剩余物无铁和铝;故溶液中要含有亚铁离子,最后烧杯中的溶液不可能是无色的;乙、丙实验后的剩余物倾倒至一个烧杯中剩余物无铁和铝,说明乙实验中,CuSO4溶液一定是过量的
解答 解:①铁能与硫酸铜反应生成了铁和硫酸亚铁,所以实验的现象是:铁表面附着红色固体,溶液由蓝色变为浅绿色.
②若将上述实验之一替换掉一种药品,即可达成实验目的.由于铁排在氢的前面,铜排在氢的后面,故可以将乙实验中的硫酸铜溶液换为稀硫酸;
③将甲实验的剩余物倒入此烧杯,无气泡产生,说明剩余物无铁和铝;故溶液中要含有亚铁离子,最后烧杯中的溶液不可能是无色的;乙、丙实验后的剩余物倾倒至一个烧杯中剩余物无铁和铝,说明乙实验中,CuSO4溶液一定是过量的.所以A、B正确,C、D错误.
故答为:①铁表面附着红色固体,溶液由蓝色变为浅绿色;②将乙实验中的硫酸铜溶液换为稀硫酸;
③A、B.
点评 了解有关金属及其锈蚀的相关知识,书写化学方程式时要按步骤规范完成.验证三种金属活动性强弱关系时,通常采取“三取中”即:取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.

练习册系列答案
相关题目
6.下列有关催化剂的说法正确的是( )
| A. | 在化学反应后其质量减少 | B. | 在化学反应后其质量增加 | ||
| C. | 在化学反应后其化学性质发生改变 | D. | 催化剂能改变反应的速率 |
8.化学小组同学发现在面包制作过程中加入了一些白色粉末,使面包变得松软.同学们对白色粉末的成分进行探究.
【查阅资料】①经调查,市场上有以下3种主要产品.
②氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑; NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑; 2NH3+H2SO4═(NH4)2SO4
【实验准备】同学们选用下列实验装置,经组合进行实验:

【实验记录】
【实验分析】
根据上述实验,甲同学认为该粉末的主要成分为食臭粉,乙同学认为上述实验不能确定该粉末为食臭粉.为进一步确认其组成及含量,同学们设计了如下定量实验:
(1)实验3中装置B的作用是除尽水蒸气和氨气.
(2)实验3中测得装置D增重a g,a的范围是>4.4.
(3)若测得a为92.4,该碱性膨松剂中NaHCO3与NH4HCO3的质量比为3360:79(结果用最简整数比表示).
【查阅资料】①经调查,市场上有以下3种主要产品.
| 商品名称 | 小苏打 | 食臭粉 | 混合碱性膨松剂 |
| 主要成分 | 碳酸氢钠 | 碳酸氢铵 | 碳酸氢钠和碳酸氢铵 |
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑; NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑; 2NH3+H2SO4═(NH4)2SO4
【实验准备】同学们选用下列实验装置,经组合进行实验:

【实验记录】
| 实验序号 | 实验装置 | 实验现象 | 实验结论及分析 |
| 实验1 | 选用A、B、C | C中澄清石灰水变浑浊 | 有CO2生成,C中反应的化学方程式是 CO2+Ca(OH)2═CaCO3↓+H2O |
| 实验2 | 选用A、 D和E | E中紫色石蕊溶液变成 蓝色 | 有NH3生成 |
根据上述实验,甲同学认为该粉末的主要成分为食臭粉,乙同学认为上述实验不能确定该粉末为食臭粉.为进一步确认其组成及含量,同学们设计了如下定量实验:
| 实验序号 | 实验目的 | 实验装置 | 数据记录 | 实验结论 |
| 实验3 | 测定生成CO2的质量 | 选用A、B、D | 装置D增重a g | 该粉末为“混合碱性膨松剂” |
| 实验4 | 测定生成NH3的质量 | 选用A、B、D | 装置B增重1.7g |
(2)实验3中测得装置D增重a g,a的范围是>4.4.
(3)若测得a为92.4,该碱性膨松剂中NaHCO3与NH4HCO3的质量比为3360:79(结果用最简整数比表示).
15.X是合成维生素A的原料.物质甲和乙在一定条件下反应可生成物质丙和X,甲、乙和丙的微观示意图见.
(1)X属于化合物(填“单质”或“化合物”).
(2)该反应中甲、乙、丙的质量比为23:17:1,则X中各元素的质量比为m(Na):m(N):m(H)=23:14:2.
| 物质 | 甲 | 乙 | 丙 |  |
| 微观 示意图 |  |  |  |
(2)该反应中甲、乙、丙的质量比为23:17:1,则X中各元素的质量比为m(Na):m(N):m(H)=23:14:2.
5. 小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:
小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:
【资料卡片】:
(1)Na和冷水剧烈反应,2Na+2H2O═2NaOH+H2↑;
(2)镁和冷水反应缓慢,和沸水反应剧烈,Mg+2H2O═Mg(OH)2+H2↑;
(3)Al和沸水反应非常缓慢,2Al+6H2O═2Al(OH)3+3H2↑;
Ⅰ、从上述资料中,你能得出金属和水反应的条件和产物有何不同和相似之处?
(1)相同点:都生成碱和氢气;
(2)不同点:反应的剧烈程度不同.
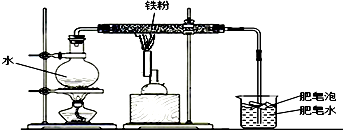
Ⅱ、小明对此非常好奇,在老师的帮助下,查阅了相关资料并做了铁粉在高温条件下和水蒸气的反应,装置如下图所示:
【资料卡片】:
A、铁的氧化物的热稳定性顺序是FeO(黑色)>Fe3O4>Fe2O3,且Fe3O4有磁性;
B、Fe2O3分解温度在1400℃以上,Fe3O4分解温度在1538℃以上;
C、Fe(OH)2是一种白色固体,在空气很快变成灰绿色,最终变为红褐色.
实验进行2分钟后,用燃着的木条点燃肥皂泡,可以观察到一团火焰.同时发现玻璃管内灰黑色物质先红热,最终变成黑色晶体,整个实验持续10分钟左右.
(1)你认为该反应为什么要在高温下才能进行?保证了四氧化三铁、氧化铁的分解;
(2)火焰的产生,说明该反应生成了氢气,在点燃该气体前,一定要检验纯度;
(3)实验结束后,所进行的实验操作应该是先撤导管,后熄灭酒精灯.这样做的目的是防止水槽中水倒流,炸裂试管.
Ⅲ、通过Ⅱ中的实验现象,大家对反应后玻璃管中残留的黑色物质的成分猜想如下:
1:Fe(OH)3;2:Fe(OH)2;3:FeO;4:Fe2O3;5:Fe3O4;6:Fe.(可多填)
甲同学认为:猜想1、2、4明显错误,理由是氢氧化铁、氢氧化亚铁、氧化铁热稳定性差;
对于其他猜想,同学们又做了如下实验:
甲同学根据实验现象,认为此黑色物质是Fe3O4,但对于他的结论,乙同学认为不妥,他的理由是铁也能被磁铁吸引;
根据甲、乙两同学的实验,还可以排除猜想3、5,理由是氧化亚铁、四氧化三铁不会与稀盐酸反应生成气体;
为进一步确认此黑色物质,同学们再次进行了实验:
结合资料综合分析,回答下列问题:
(1)玻璃管中残留的黑色物质应为碳,铁粉和水蒸气在高温下反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,属于置换反应;
(2)实验1中的A溶液为硫酸铜溶液,加A溶液的目的是验证黑色物质中含有铁.
Ⅳ、丙同学用定量的方法确定实验后玻璃管中黑色物质的组成.方案如下:
将5.6gFe粉和足量的H2O(气)充分反应后,得到7.2g黑色固体,再将此黑色固体加入150g足量稀盐酸中继续反应,充分反应后,称得烧杯内溶液质量为157.15g.请根据上述数据计算出7.2g黑色物质的组成,确证上述探究结论.(写出计算过程)
Ⅴ、反思评价:
(1)该氧化物又可以经过此反应的逆反应生成颗粒很细的铁粉.这种铁粉具有很高的反应活性,在空气中受撞击或加热时会燃烧,所以俗称“引火铁”.写出此反应的化学方程式:
Fe3O4+4H2$\frac{\underline{\;高温\;}}{\;}$3Fe+4H2O;
(2)砖窑用粘土烧制青砖(颜色发黑的砖)时,窑内温度可达1150℃,Fe2O3和H2反应生成FeO,写出该反应的化学方程式Fe2O3+H2$\frac{\underline{\;1150℃\;}}{\;}$2FeO+H2O.
 小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:
小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:【资料卡片】:
(1)Na和冷水剧烈反应,2Na+2H2O═2NaOH+H2↑;
(2)镁和冷水反应缓慢,和沸水反应剧烈,Mg+2H2O═Mg(OH)2+H2↑;
(3)Al和沸水反应非常缓慢,2Al+6H2O═2Al(OH)3+3H2↑;
Ⅰ、从上述资料中,你能得出金属和水反应的条件和产物有何不同和相似之处?
(1)相同点:都生成碱和氢气;
(2)不同点:反应的剧烈程度不同.
Ⅱ、小明对此非常好奇,在老师的帮助下,查阅了相关资料并做了铁粉在高温条件下和水蒸气的反应,装置如下图所示:
【资料卡片】:
A、铁的氧化物的热稳定性顺序是FeO(黑色)>Fe3O4>Fe2O3,且Fe3O4有磁性;
B、Fe2O3分解温度在1400℃以上,Fe3O4分解温度在1538℃以上;
C、Fe(OH)2是一种白色固体,在空气很快变成灰绿色,最终变为红褐色.
实验进行2分钟后,用燃着的木条点燃肥皂泡,可以观察到一团火焰.同时发现玻璃管内灰黑色物质先红热,最终变成黑色晶体,整个实验持续10分钟左右.
(1)你认为该反应为什么要在高温下才能进行?保证了四氧化三铁、氧化铁的分解;
(2)火焰的产生,说明该反应生成了氢气,在点燃该气体前,一定要检验纯度;
(3)实验结束后,所进行的实验操作应该是先撤导管,后熄灭酒精灯.这样做的目的是防止水槽中水倒流,炸裂试管.
Ⅲ、通过Ⅱ中的实验现象,大家对反应后玻璃管中残留的黑色物质的成分猜想如下:
1:Fe(OH)3;2:Fe(OH)2;3:FeO;4:Fe2O3;5:Fe3O4;6:Fe.(可多填)
甲同学认为:猜想1、2、4明显错误,理由是氢氧化铁、氢氧化亚铁、氧化铁热稳定性差;
对于其他猜想,同学们又做了如下实验:
| 实验方案 | 实验现象 | |
| 甲 | 将磁铁靠近黑色粉末 | 黑色粉末可被磁铁全部吸引 |
| 乙 | 取少量黑色粉末加入稀盐酸中 | 有气泡 |
根据甲、乙两同学的实验,还可以排除猜想3、5,理由是氧化亚铁、四氧化三铁不会与稀盐酸反应生成气体;
为进一步确认此黑色物质,同学们再次进行了实验:
| 实验方案 | 实验现象 | 结论或化学方程式 |
| 1、取实验后的黑色粉末,加入足量的A溶液,搅拌使反应充分. | 黑色物质表面有红色物质,溶液颜色出现较浅的绿色,烧杯底部仍有较多黑色物质 | Fe+CuSO4=FeSO4+Cu |
| 2、过滤、洗涤、干燥,再用磁铁吸引 | 黑色物质可被磁铁全部吸引,留下红色固体 | 被磁铁吸引的物质是铁 |
(1)玻璃管中残留的黑色物质应为碳,铁粉和水蒸气在高温下反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,属于置换反应;
(2)实验1中的A溶液为硫酸铜溶液,加A溶液的目的是验证黑色物质中含有铁.
Ⅳ、丙同学用定量的方法确定实验后玻璃管中黑色物质的组成.方案如下:
将5.6gFe粉和足量的H2O(气)充分反应后,得到7.2g黑色固体,再将此黑色固体加入150g足量稀盐酸中继续反应,充分反应后,称得烧杯内溶液质量为157.15g.请根据上述数据计算出7.2g黑色物质的组成,确证上述探究结论.(写出计算过程)
Ⅴ、反思评价:
(1)该氧化物又可以经过此反应的逆反应生成颗粒很细的铁粉.这种铁粉具有很高的反应活性,在空气中受撞击或加热时会燃烧,所以俗称“引火铁”.写出此反应的化学方程式:
Fe3O4+4H2$\frac{\underline{\;高温\;}}{\;}$3Fe+4H2O;
(2)砖窑用粘土烧制青砖(颜色发黑的砖)时,窑内温度可达1150℃,Fe2O3和H2反应生成FeO,写出该反应的化学方程式Fe2O3+H2$\frac{\underline{\;1150℃\;}}{\;}$2FeO+H2O.
12.下列排列顺序正确的是( )
| A. | 空气中物质的含量:$→_{由少到多}^{CO_{2}N_{2}O_{2}}$ | |
| B. | 利用金属的年代:$→_{由先到后}^{CuFeAl}$ | |
| C. | 溶液的pH:$→_{由小到大}^{NaClNaOHHCl}$ | |
| D. | 铜元素的质量分数:$→_{由低到高}^{Cu_{2}OCuOCuS}$ |
