题目内容
15.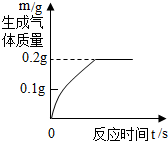 将6.8g含杂质的锌粒,加入到盛有50.0g稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应)正好完全反应,生成气体与时间关系如图,过滤得溶液质量为56.6g.试计算:
将6.8g含杂质的锌粒,加入到盛有50.0g稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应)正好完全反应,生成气体与时间关系如图,过滤得溶液质量为56.6g.试计算:(1)生成氢气的质量为0.2 g.
(2)稀硫酸溶液中溶质的质量分数(精确到0.1%).
分析 锌和稀硫酸反应生成硫酸锌和氢气,反应前后的质量差即为反应生成氢气的质量,根据氢气的质量可以计算硫酸的质量,进一步可以计算稀硫酸溶液中溶质的质量分数.
解答 解:(1)生成氢气的质量为:6.8g+50.0g-56.6g=0.2g,
故填:0.2.
(2)设稀硫酸中硫酸质量为x,
Zn+H2SO4═ZnSO4+H2↑,
98 2
x 0.2g
$\frac{98}{x}$=$\frac{2}{0.2g}$,
x=9.8g,
稀硫酸溶液中溶质的质量分数为:$\frac{9.8g}{50.0g}$×100%=19.6%,
答:稀硫酸溶液中溶质的质量分数为19.6%.
点评 判断生成氢气的质量时,可以通过计算判断,也可以根据图中数据判断,要注意理解.

练习册系列答案
相关题目
3.学习化学过程中需要常做实验,下列实验操作不正确的是( )
| A. |  闻气味 | B. |  倾倒液体 | ||
| C. |  粉末状药品取用 | D. |  称量NaOH |
20.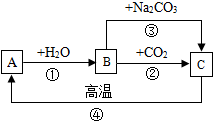 A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去).下列说法不正确的是( )
A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去).下列说法不正确的是( )
 A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去).下列说法不正确的是( )
A、B、C是三种常见的含钙化合物.它们之间有如图所示的转化关系(部分产物略去).下列说法不正确的是( )| A. | A物质的化学式是:CaO | |
| B. | B物质的俗称是:熟石灰或(消石灰) | |
| C. | C物质的名称是:水 | |
| D. | B物质在农业生产中的一种用途:中和酸性土壤 |
 向一定量的NaHCO3和NaOH的溶合稀溶液中,逐滴加入稀的盐酸溶液,所发生的现象,可用如图表示.请问:
向一定量的NaHCO3和NaOH的溶合稀溶液中,逐滴加入稀的盐酸溶液,所发生的现象,可用如图表示.请问: