题目内容
19.下列物质中含有+2价的碳元素的是( )| A. | C | B. | CO | C. | CO2 | D. | H2CO3 |
分析 根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.
解答 解:A、根据单质中元素的化合价为0,C属于单质,碳元素的化合价为0,故选项错误.
B、氧元素显-2价,设碳元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)=0,则x=+2价,故选项正确.
C、氧元素显-2价,设碳元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:y+(-2)×2=0,则y=+4价,故选项错误.
D、氢元素显+1价,氧元素显-2价,设碳元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)×2+z+(-2)×3=0,则z=+4价,故选项错误.
故选:B.
点评 本题难度不大,掌握单质中元素的化合价为0、在化合物中正负化合价代数和为零并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
9.此表列出了除去物质中所含少量杂质的方法,合理的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | 炭粉 | Cu粉 | 通入过量氧气,加热 |
| B | CO2气体 | CO | 通入过量氢氧化钠溶液 |
| C | NaCl | CaCO3 | 加入过量水溶解、过滤后取滤液,蒸发 |
| D | MgCl2溶液 | CuCl2 | 加入过量NaOH溶液,充分反应后过滤,得到滤液 |
| A. | A | B. | B | C. | C | D. | D |
10.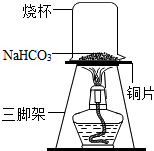 糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为9,由此得出结论是碳酸氢钠溶液呈碱性.
【探究实验二】碳酸氢钠的热稳定性:取一定量碳酸氢钠放在铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到石灰水变浑浊.
(3)通过进一步实验来确定充分加热后的固体产物的成分.限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
(4)根据上述实验结论,写出碳酸氢钠受热分解的化学方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O..
 糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.
糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究.【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为9,由此得出结论是碳酸氢钠溶液呈碱性.
【探究实验二】碳酸氢钠的热稳定性:取一定量碳酸氢钠放在铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到石灰水变浑浊.
(3)通过进一步实验来确定充分加热后的固体产物的成分.限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量氯化钙溶液,振荡,静置 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加酚酞溶液 | 溶液不变色 | 产物不含NaOH |
7.据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与
小组同学共同完成以下探究:
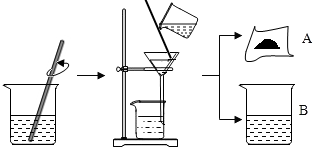
【提出问题1】固体A中的成分是什么?
【查阅资料】
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
②碳酸钾与碳酸钠性质相似,在溶液中都能与氢氧化钙发生复分解反应.
【猜想与假设】甲同学:只有CaCO3 乙同学:CaCO3、Ca(OH)2 丙同学:CaCO3、CaO
甲、乙两位同学认为丙同学的猜想不合理,理由是CaO+H2O=Ca(OH)2(用化学方程式表示).
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了下述实验:
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是CaCO3和Ca(OH)2混合物加入盐酸也会有气体产生,所以不能证明固体中只有CaCO3;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分.
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】猜想1:KOH、K2CO3 猜想2:KOH、Ca(OH)2 猜想3:KOH
【表达与交流】结合上述实验,同学们讨论确定了猜想2正确,理由是反应后一定有KOH生成,上述实验中乙同学证明了固体含有Ca(OH)2,则溶液中一定存在溶解的Ca(OH)2.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为Ca(OH)2+K2CO3═CaCO3↓+2KOH.
小组同学共同完成以下探究:

【提出问题1】固体A中的成分是什么?
【查阅资料】
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
②碳酸钾与碳酸钠性质相似,在溶液中都能与氢氧化钙发生复分解反应.
【猜想与假设】甲同学:只有CaCO3 乙同学:CaCO3、Ca(OH)2 丙同学:CaCO3、CaO
甲、乙两位同学认为丙同学的猜想不合理,理由是CaO+H2O=Ca(OH)2(用化学方程式表示).
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了下述实验:
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,向其中加入稀盐酸. | 有气泡产生 | 自己的猜想正确 |
| 乙同学:取少量固体于试管中,加水溶解后过滤,向滤液中加入酚酞溶液 | 滤液变为红色 | 自己的猜想正确 |
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】猜想1:KOH、K2CO3 猜想2:KOH、Ca(OH)2 猜想3:KOH
【表达与交流】结合上述实验,同学们讨论确定了猜想2正确,理由是反应后一定有KOH生成,上述实验中乙同学证明了固体含有Ca(OH)2,则溶液中一定存在溶解的Ca(OH)2.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为Ca(OH)2+K2CO3═CaCO3↓+2KOH.
14.把锌片放入下列液体中反应,液体的质量比反应前减小的是( )
| A. | AgNO3溶液 | B. | FeSO4溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
4.物质的性质决定了物质的用途.下列几种常见物质的性质、用途不一致的是( )
| A. | 氮气 性质稳定 保护气 | |
| B. | 酒精 可燃性 消毒剂 | |
| C. | 食醋 酸性 除水垢 | |
| D. | 干冰 升华吸热 人工降雨 |
11.下列说法正确的是( )
| A. | 煤、乙醇、石油属于不可再生能源 | |
| B. | 氧气不充足时,燃料中的碳不能充分燃烧,产生黑烟、生成CO等物质 | |
| C. | 用肥皂水区分硬水和软水,易起浮渣的是软水 | |
| D. | 催化剂能够加快其他物质的化学反应速率而本身的质量和性质不发生改变 |
8.下列各组转化中,一定条件下均能一步实现的组合是( )


| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
4.下列有关水和水的电解说法正确的是( )
| A. | 水是由氢气和氧气组成的 | |
| B. | 电源正极产生氧气,负极产生氢气 | |
| C. | 电解产生的氢气和氧气的质量比为1:2 | |
| D. | 负极产生的气体可以使带火星的木条复燃 |