题目内容
15.Ca(OH)2在不同温度时的溶解度如下表所示:| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 0.18 | 0.16 | 0.14 | 0.11 | 0.09 |
| A. | 40℃时,降低Ca(OH)2饱和溶液温度会析出溶质Ca(OH)2 | |
| B. | 60℃时,Ca(OH)2形成的饱和溶液中溶质和溶液的质量比为0.11:100.11 | |
| C. | 20℃时,向Ca(OH)2饱和溶液中加入CaO,反应后将溶液温度恢复到20℃,溶液质量变大.[CaO+H2O=Ca(OH)2] | |
| D. | 20℃时,向50g水中加入0.1克Ca(OH)2,得到溶液中溶质的质量分数计算式为:$\frac{0.1}{50.1}$×100% |
分析 A、根据氢氧化钙的溶解度随温度的升高而减小进行分析;
B、根据60℃时,Ca(OH)2的溶解度进行分析;
C、根据氧化钙和水反应生成氢氧化钙,消耗了水的质量,所以溶液质量减少进行分析;
D、根据20℃时,Ca(OH)2的溶解度进行分析.
解答 解:A、氢氧化钙的溶解度随温度的升高而减小,降温不会析出晶体,故A错误;
B、60℃时,Ca(OH)2的溶解度是0.11g,100g水中最多溶解0.11g,所以形成的饱和溶液中溶质和溶液的质量比为0.11:100.11,故B正确;
C、氧化钙和水反应生成氢氧化钙,消耗了水的质量,所以溶液质量减少,故C错误;
D、20℃时,Ca(OH)2的溶解度0.16g,向50g水中加入0.1克Ca(OH)2,得到溶液中溶质的质量分数计算式为:$\frac{0.08g}{50g+0.08g}$×100%,故D错误.
故选:B.
点评 本题难度不是很大,主要考查了固体溶解度曲线表示的意义及根据固体的溶解度曲线来解决相关的问题.

练习册系列答案
相关题目
16.下列说法错误的是( )
| A. | 在溶液中K+和SO42-能大量共存 | |
| B. | 氯化钠是由氯化钠分子构成的 | |
| C. | 最外层电子数决定了元素的化学性质 | |
| D. | 氯离子和氯原子的核外电子层数相同 |
10.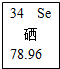 硒可用作静电复印硒鼓的材料.元素周期表中“硒”的信息如图所示.下列有关硒元素的说法错误的是( )
硒可用作静电复印硒鼓的材料.元素周期表中“硒”的信息如图所示.下列有关硒元素的说法错误的是( )
 硒可用作静电复印硒鼓的材料.元素周期表中“硒”的信息如图所示.下列有关硒元素的说法错误的是( )
硒可用作静电复印硒鼓的材料.元素周期表中“硒”的信息如图所示.下列有关硒元素的说法错误的是( )| A. | 是非金属元素 | B. | 原子序数为34 | ||
| C. | 元素符号是Se | D. | 相对原子质量为78.96g |
5.建立宏观与微观的联系是化学特有的思维方式.下列对于宏观现象的微观解释中,错误的是( )
| A. | 蔗糖放入水中,逐渐消失,说明分子在不断运动 | |
| B. | 水通直流电分解,是因为水分子被破坏,形成新的分子 | |
| C. | 二氧化碳气体制成干冰,是因为二氧化碳分子的体积减小 | |
| D. | 一氧化碳和二氧化碳具有不同的化学性质,是因为构成它们的分子不同 |

