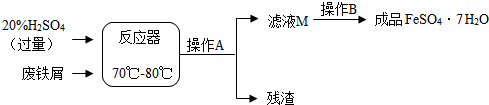
题目内容
学完了金属的化学性质后,同学们做了以下实验:
(1)甲同学先将铝条用砂纸打磨光亮后再浸入硫酸铜溶液.他这样操作的原因是什么?
(2)乙同学往ZnSO4和CuSO4的混合溶液中加入过量铁粉,充分反应后过渡,则滤纸上会得到哪些物质?
(3)请你帮助丙同学设计一种实验方案来探究Fe、Cu、Ag三种金属的活动性顺序.(写出所需试剂即可).
(1)甲同学先将铝条用砂纸打磨光亮后再浸入硫酸铜溶液.他这样操作的原因是什么?
(2)乙同学往ZnSO4和CuSO4的混合溶液中加入过量铁粉,充分反应后过渡,则滤纸上会得到哪些物质?
(3)请你帮助丙同学设计一种实验方案来探究Fe、Cu、Ag三种金属的活动性顺序.(写出所需试剂即可).
考点:金属的化学性质,金属活动性顺序及其应用
专题:金属与金属材料
分析:(1)根据金属铝与氧气反应的性质,分析实验前进行打磨的目的;
(2)根据金属活动性强弱关系Zn>Fe>Cu,铁粉不和混合溶液中的ZnSO4反应,但却能置换出CuSO4中的Cu;加入过量的铁粉,充分反应后过滤,混合溶液中的CuSO4全部反应,生成铜和FeSO4,且铁粉有剩余.
(3)在金属活动性顺序中,设计实验证明金属的活动性顺序,可以使用活动性居中的金属为盐溶液,强和弱的金属为单质的方法.
(2)根据金属活动性强弱关系Zn>Fe>Cu,铁粉不和混合溶液中的ZnSO4反应,但却能置换出CuSO4中的Cu;加入过量的铁粉,充分反应后过滤,混合溶液中的CuSO4全部反应,生成铜和FeSO4,且铁粉有剩余.
(3)在金属活动性顺序中,设计实验证明金属的活动性顺序,可以使用活动性居中的金属为盐溶液,强和弱的金属为单质的方法.
解答:解:
(1)由于铝能与空气中氧气发生反应,使表面形成金属氧化物保护膜,影响实验,因此要使用砂纸进行打磨;故答为:除去表面的金属氧化物保护膜;
(2)由于金属活动性强弱关系Zn>Fe>Cu,所以过量的Fe粉可以置换出混合溶液中的Cu,而不能置换出锌,所以,过滤后所得固体应该为铁和铜的混合粉末;
故答为:过滤后滤纸上所得固体应该为铁和铜的混合粉末;
(3)在金属活动性顺序中,Fe>Cu>Ag,使用活动性强的金属铁和活动性弱的金属银,则可以用铜的盐溶液.所以,实验方案是:把铁和银放入硫酸铜溶液中,铁表面有红色物质析出,银与硫酸铜不反应,证明铁的活动性比铜强,铜的活动性比银强;
故答为:方案是:把铁和银放入硫酸铜溶液中,铁表面有红色物质析出,银与硫酸铜不反应,证明铁的活动性比铜强,铜的活动性比银强;
故答案为:(1)(2)(3)
(1)由于铝能与空气中氧气发生反应,使表面形成金属氧化物保护膜,影响实验,因此要使用砂纸进行打磨;故答为:除去表面的金属氧化物保护膜;
(2)由于金属活动性强弱关系Zn>Fe>Cu,所以过量的Fe粉可以置换出混合溶液中的Cu,而不能置换出锌,所以,过滤后所得固体应该为铁和铜的混合粉末;
故答为:过滤后滤纸上所得固体应该为铁和铜的混合粉末;
(3)在金属活动性顺序中,Fe>Cu>Ag,使用活动性强的金属铁和活动性弱的金属银,则可以用铜的盐溶液.所以,实验方案是:把铁和银放入硫酸铜溶液中,铁表面有红色物质析出,银与硫酸铜不反应,证明铁的活动性比铜强,铜的活动性比银强;
故答为:方案是:把铁和银放入硫酸铜溶液中,铁表面有红色物质析出,银与硫酸铜不反应,证明铁的活动性比铜强,铜的活动性比银强;
故答案为:(1)(2)(3)
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.前边的金属会把后边的金属从其盐溶液中置换出

练习册系列答案
相关题目
下列物质久置敞口容器中,质量会增加但不会变质的是( )
| A、浓硫酸 | B、氢氧化钠 |
| C、食盐 | D、浓盐酸 |
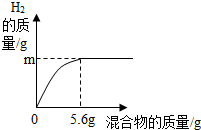 现有两种金属单质组成的混合物.向100g稀盐酸中加入该混合物,加入混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是( )
现有两种金属单质组成的混合物.向100g稀盐酸中加入该混合物,加入混合物的质量与生成氢气的质量关系如图所示.下列说法正确的是( )| A、若混合物为Zn和Cu,则m大于0.2 g |
| B、若混合物为Zn和Fe,则m可能是0.2 g |
| C、若混合物为Fe和Cu,稀盐酸中溶质质量分数为7.3% |
| D、若混合物为Fe和Cu,m为0.1 g,则混合物中Fe和Cu的质量比为1:1 |
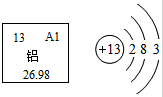 铝在生产生活中的应用非常广泛,如图为铝在元素周期表中的信息和原子结构示意图,由此不能得到的信息是( )
铝在生产生活中的应用非常广泛,如图为铝在元素周期表中的信息和原子结构示意图,由此不能得到的信息是( )| A、铝是地壳中含量最多的金属元素 |
| B、铝原子的质子数、核外电子数均为13 |
| C、在化学变化中每个铝原子可失去3个电子变成Al3+ |
| D、铝元素在化合物通常显+3价 |