题目内容
【题目】5克铁、锌、镁三种金属的混合物与100g某浓度的稀硫酸刚好完全反应,生成0.2g氢气,则反应后所得溶液中溶质的总质量是( )
A. 0.2gB. 10.2gC. 14.6gD. 104.8g
【答案】C
【解析】
5克铁、锌、镁三种金属与100g的稀硫酸恰好完全反应,生成氢气0.2g,根据反应前后元素质量不变,则硫酸亚铁、硫酸锌、硫酸镁三种物质的混合物中含硫酸根的质量等于硫酸中硫酸根的质量;根据硫酸中氢与硫酸根的比,计算出硫酸根的质量再加上铝、锌、镁的混合物5g,即产生固体硫酸亚铁、硫酸锌、硫酸镁混合物的质量.
解:根据硫酸的化学式H2SO4,其中氢元素与硫酸根的质量比=2:96=1:48,当硫酸中所含氢元素的质量为0.2g时,硫酸根的质量=0.2g÷![]() =9.6g, 反应后所得溶液中溶质的总质量为:5+9.6g=14.6g,故选C。
=9.6g, 反应后所得溶液中溶质的总质量为:5+9.6g=14.6g,故选C。

【题目】某学习小组对用碳酸盐可以制取CO2进行如下研究:
(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
生成CO2质量/g | 2 | 4 | 6 | 8 | 12 | |
时间/s | 块状碳酸钙固体 | 10 | 25 | 40 | 60 | 85 |
块状纯碱晶体 | 4 | 9 | 15 | 25 | 40 | |
①从表中数据获得信息_____.
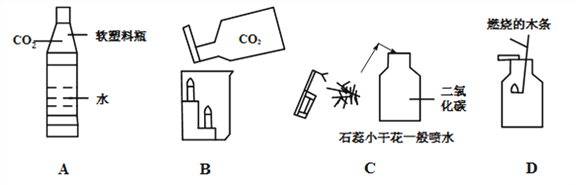
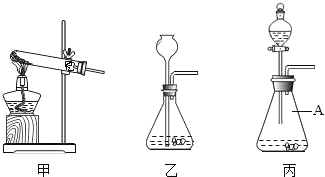
②如图是一组实验装置,该实验除用到电子秤外,还需用图中_____装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在所选装 置的导管口检验生成的气体,观察到的现象为_____,由此她认为产生的气体为CO2.小军同学认为小红同学的验证不严密,理由是_____.
④请写出块状碳酸钙固体与稀盐酸反应方程式为_____.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需_____(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?_____,因为:_____.
A 块状石灰石与稀盐酸 B 块状石灰石与稀硫酸
C 块状纯碱晶体与稀盐酸 D 块状纯碱晶体与稀硫酸
(3)丙图中标号仪器A的名称为_____,用装置甲制取氧气的化学反应方程式为_____.