题目内容
16. 今年全市化学实验考查的实验之一是制取、收集一瓶氧气并探究铁丝在氧气中的燃烧.
今年全市化学实验考查的实验之一是制取、收集一瓶氧气并探究铁丝在氧气中的燃烧.(1)小明利用上述A装置来制取和收集一瓶氧气.
①仪器①的名称长颈漏斗.
②利用该装置制取氧气的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,但他最终却没能收集到一瓶氧气,经检查发现A装置有一个明显的错误长颈漏斗下端未插入到液面以下.
(2)小明利用上述B装置探究铁丝在氧气中的燃烧.
①把铁丝盘成螺旋状的目是使热量不易散失,更容易达到铁丝着火点,然而遗憾的是小明在实验过程中没有看到火星四射的原因是未去除表面铁锈(写一点即可).
②通过原因查找后重新实验,看到了火星四射的现象,小明产生了两个疑惑:为什么会火星四射?燃烧溅落的“黑色固体”是什么?小明查阅了资料,发现:①用来做燃烧实验的铁丝往往是生铁,生铁中含有少量的碳元素,纯铁中不含碳元素,会不会是这个原因造成现象的差异呢?②铁粉、四氧化三铁均是黑色或灰黑色粉末,均能溶于稀盐酸(四氧化三铁+盐酸→两种含铁元素的盐+水),且氧化物先于金属与酸反应;③氯化铁溶液与铁先于盐酸与铁反应,生成氯化亚铁.
探究1:“火星四射”的现象与铁丝含碳量的关系
| 实验操作 | 实验现象 | 实验结论 |
| 实验1:取直径0.20mm,含碳0.1%的铁丝,在氧气中燃烧 | 零星火星 | “火星四射”与铁丝含碳量的关系是:B含碳量越高,火星四射越明显. |
| 实验2:取直径0.20mm,含碳0.3%的铁丝,在氧气中燃烧 | 较明显的火星四射 | |
| 实验3:取直径A0.20mm,含碳0.5%的铁丝,在氧气中燃烧 | 明显的火星四射 |
②铁丝在氧气中燃烧的化学方程式是3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
③分析原因:碳元素在燃烧过程中生成了CO2气体,气体将铁与氧气反应生成的金属熔化物推了出去,从而产生了火星四射现象.
探究2:黑色固体中是否含有铁?
小明质疑小刚用磁铁来检验黑色固体是否含有铁的方案,其理由是Fe3O4也能被磁铁吸引;
小明也质疑下表小军的检验黑色固体是否含有铁的方案:
| 实验操作 | 实验现象 | 实验结论 |
| 取部分黑色固体于试管中,加入一定量稀盐酸,放置一段时间 | 未看到气泡产生,溶液由无色变为黄绿色 | 黑色固体中不含有铁 |
②小明质疑小军实验方案的理由是盐酸不足,或铁先于氯化铁反应后没有剩余.
分析 (1)熟记仪器的名称、制取氧气的反应原理以及注意事项;
(2)小陈把铁丝做成螺旋状的目的是:增大铁丝的受热面积,使铁丝燃烧更容易进行.此实验失败的可能原因较多,例如:铁丝表面有锈、铁丝过粗、氧气纯度不够等.
探究1:①根据控制变量法的实验设计以及实验现象来分析;
②根据反应的原理以及化学方程式的写法来分析;
探究2:①根据四氧化三铁也能被磁铁吸引来分析;
②根据反应的原理来分析书写;
③根据反应的量来分析.
解答 解:(1)①仪器①的名称是长颈漏斗;故填:长颈漏斗;
②该装置适用于固体与液体在常温下反应制取氧气,即过氧化氢在二氧化锰的催化作用下分解为水和氧气;在这个装置中长颈漏斗的末端一定要伸入液面以下,否则会造成氧气从长颈漏斗逸出而收集不到氧气;故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,长颈漏斗下端未插入到液面以下;
(2)①把铁丝盘成螺旋状的目是使热量不易散失,更容易达到铁丝着火点;没有出现火星四射的现象的原因可能是铁丝表面有锈、铁丝过粗、氧气纯度不够等;故填:使热量不易散失,更容易达到铁丝着火点;未去除表面铁锈(合理即可);
探究1:①由控制变量法的实验设计思路可知,要探究“火星四射”的现象与铁丝含碳量的关系时,需要选择粗细相同的铁丝;由实验数据和实验现象可知,“火星四射”与铁丝含碳量的关系是含碳量越高,火星四射越明显;故填:0.20;含碳量越高,火星四射越明显;
②铁丝在氧气中燃烧生成四氧化三铁;故填:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
探究2:①四氧化三铁也能被磁铁吸引,所以不能用磁铁来检验是否含有铁;故填:Fe3O4也能被磁铁吸引;
②溶液为黄绿色,说明反应后生成了氯化铁和氯化亚铁,故填:Fe3O4+8HCl═FeCl2+2FeCl3+4H2O;
③在实验过程中,若加入的稀盐酸不足量,或者铁先于氯化铁反应而没有剩余,是无法得出此结论的,故填:盐酸不足,或铁先于氯化铁反应后没有剩余.
点评 本题通过对比实验探究考查铁丝燃烧的现象,同时要求能从探究中学会对比分析.

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | 复合材料 | B. | 金属材料 | C. | 合成材料 | D. | 非金属材料 |
 X、Y两种固体(均不带结晶水)物质的溶解度曲线如图所示,下列有关叙述正确的是( )
X、Y两种固体(均不带结晶水)物质的溶解度曲线如图所示,下列有关叙述正确的是( )| A. | t2℃时,用160g X的饱和溶液加水可以配成500g12.5%的X溶液 | |
| B. | t2℃时,X和Y的两杯饱和溶液降到t1℃,析出的X一定比Y多 | |
| C. | 向M点65g X溶液中加入15g X固体能得到t2℃X的饱和溶液 | |
| D. | t1℃时,X和Y的饱和溶液升到t2℃,溶质的质量分数都增大 |
| 序号 | 物质 | 杂质 | 除杂方法 |
| A. | MnO2 | KCl | 加水溶解、过滤、洗涤、干燥 |
| B. | CO2 | CO | 空气中点燃 |
| C. | NaOH溶液 | Na2CO3 | 加入稀盐酸至不再产生气泡 |
| D. | ZnCl2溶液 | CuCl2 | 加入足量铁粉充分反应、过滤 |
| A. | A | B. | B | C. | C | D. | D |
 某研究小组发现,维C泡腾片(保健品,主要成分见图1)溶于水,有许多气泡产生(如图2).该小组同学进行如下探究:
某研究小组发现,维C泡腾片(保健品,主要成分见图1)溶于水,有许多气泡产生(如图2).该小组同学进行如下探究:探究一:该气体的成分.
【猜想与假设】
小华说:该气体可能是CO2、O2、CO、H2、N2中的一种或几种.
小明说:不可能含有N2,因为:根据质量守恒定律(或化学反应前后元素种类不变),反应物中不含氮元素
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO有毒
经讨论,最后该小组同学认为:该气体可能含有CO2、O2中的一种或两种.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
| ② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(1)由实验①可知,该气体中肯定含有二氧化碳,写出该反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O
(2)由实验②不能(填“能”或“不能”)确定该气体中不含氧气,理由是若生成氧气和二氧化碳的混合物,当氧气含量过少时,带火星的木条也不能复燃.
探究二:维C泡腾片溶液的酸碱性.
向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显酸性.
【拓展延伸】人体缺乏维生素C会引起坏血病.
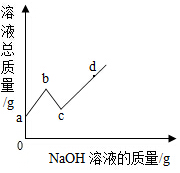 向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,某同学依据实验事实绘制了如图所示的曲线,下列说法不正确的是( )
向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,某同学依据实验事实绘制了如图所示的曲线,下列说法不正确的是( )| A. | a至b段对应溶液的pH逐渐增大 | B. | b点对应溶液中的溶质为硫酸钠 | ||
| C. | cd段的溶液滴加石蕊试液变蓝 | D. | c点对应溶液中的溶质种类最少 |

